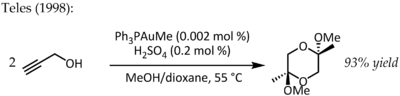Organické sloučeniny zlata
Organické sloučeniny zlata jsou organokovové sloučeniny obsahující vazby mezi atomy uhlíku a zlata. Jsou předmětem akademického výzkumu, ale nemají významné využití. Nejčastějšími oxidačními čísly zlata v těchto sloučeninách jsou I s koordinačním číslem 2 a lineární geometrií a III, kde koordinační číslo bývá 4 a geometrie molekul čtvercově rovinná.[1][2][3]
První připravenou sloučeninou tohoto typu byl v roce 1900 karbid zlatný, Au2C2.[4]
Zlatné sloučeniny
[editovat | editovat zdroj]Zlatné komplexy mají koordinační číslo 2, jsou lineární a diamagnetické a mají 14 elektronů.[1][2][3] Obvykle se vyskytují jako adukty LAuR, kde L je ligand, jako například trifenylfosfin nebo isokyanid. Ligand brání redukci Au+ na kovové zlato, a to tím, že tvoří dimer s organickou skupinou. Zlato v oxidačním čísle I také může vytvářet zlatnany, M[AuR2] (patřící mezi átové komplexy), kde je kation zpravidla navázán na komplexační činidlo, což zvyšuje jeho stabilitu. Anion AuR2− je také lineární, obdobně jako i jiné M(d10) sloučeniny, například Hg(Me)2 a Pd(Me)22+. Zlato vytváří acetylidy (schopné se spojit do polymerních struktur) a karbeny. Obvyklým způsobem přípravy slóučenin typu LAuR je reakce Grignardova činidla se zlatným halogenidem a takto získaného produktu s organolithnými sloučeninami (R-Li) na átový komplex.
U určité skupiny sloučenin jsou arylové atomy uhlíku přítomny jako můstky mezi dvěma atomy zlata. Příkladem takové sloučeniny je (2,4,6-trimethylfenyl)zlato, (MesAu)5, připravované reakcí Au(CO)Cl a mesitylového Grignardova činidla.
Na jeden atom zlata se může koordinovat až 6 atomů uhlíku. Sloučeniny typu C(AuL)4 jsou isolobální s methanem a C(AuL)5+ s methaniovým iontem. Tyto hyperkoordinované shluky jsou často stabilizovány aurofilními interakcemi mezi zlatnými centry s uzavřenými slupkami.[5]
Zlatné kyanidy (MAu(CN)2) mají význam při kyanidovém loužení zlata. Uhlík v kyanidech kovů je obvykle iontový, ovšem u vazby C-Au má vlastnosti kovalentní.[6]
Zlatité sloučeniny
[editovat | editovat zdroj]Zlatité komplexy bývají 4-koordinované, čtvercově rovinné, diamagnetické a 16elektronové sloučeniny. Někdy je formální koordinační číslo menší než 4, což způsobují ligandy, například chlor, vytvářející můstky; příčinou může být i vnitromolekulární chelatace. Většina těchto komplexů je toxická a tak jsou méně prozkoumány než zlatné; nejlépe prozkoumané jsou z této skupiny monoarylzlatité sloučeniny. Sloučeniny z této skupiny se nejčastěji připravují přímými elektrofilními auracemi arenů chloridem zlatitým.[7]
Jsou také známy homoleptické tetraalkylzlatitany, například Li[AuMe4].[8]
Použití
[editovat | editovat zdroj]Reakce katalyzované zlatem lze rozdělit do dvou skupin: na heterogenní, například využití nanočástic zlata (Au/TiO2 a další) a monovrstev thiolů na zlatých površích, a katalyzátory na hliníkových nosičích, například Au/CeO2. Tyto katalyzátory byly zkoumány pro možné využití v průmyslových procesech, jako jsou oxidace oxidu uhelnatého (CO) a selektivní hydrogenace (mimo jiné butadienu na buten). I když se v některých případech ukázaly jako účinné vysoce selektivní, tak se vyskytují určité nejistoty ohledně mechanismů reakcí katalyzovaných různými katalyzátory založenými na zlatu.
V homogenní katalýze se používají jednoduché nebo na ligandy navázané zlatné nebo zlatité sloučeniny rozpustné v organických rozpouštědlech a využitelné na výrobu čistých chemikálií.[9][10]
Na přípravu komplexů Au se používají jeho halogenidy a jednoduché komplexy, jako jsou chlorid zlatný, chlorid zlatitý a kyselina chlorozlatitá. Tyto zdroje zlata ovšem rychle vytvářejí špatně popsatelné a snadno deaktivovatelné (prostřednictvím redukce na Au0) aktiuvní katalyzátory. Rozvoj lépe popsatelných fosfinových a NHC zlatných komplexů přinesl významný pokrok a nárůst zájmu o výzkum syntetického využití katalyzátorů založených na zlatu. Zlatné komplexy se obvykle připravují a uchovávají v podobě stabilních a nereaktivních chloridů, LAuCl, jako je například chlorid (trifenylfosfin)zlatný, jež se zpravidla aktivují odstraněním halogenidových iontů stříbrnými solemi, například AgOTf, AgBF4 nebo AgSbF6, za vzniku komplexních zlatných kationtů.[11][12]
Přestože se koordinačně nenasycené komplexy LAu+ připravují ze směsí LAuCl a AgX, tak jejich přesné vlastnosti a účinek stříbrných solí dosud nejsou jisté.[13][14][15]
Jako příklady katalyticky aktivních, ale izolovatelných, prekatalyzátorů neobsahujících stříbro lze uvést p-nitrobenzoáty, bistriflimidy a některé komplexy nitrilů.
Kationtové zlatné komplexy vytváří π-komplexy s alkeny a alkyny. Zlato není jediným kovem vykazujícím tento druh vazeb a reaktivity, uvedenou vlastnost mají i některé ionty kovů isolobální s protonem (tedy obsahující prázdné s-orbitaly), například Hg2+ a Pt2+. Podobné elektrofilní ionty a komplexy se silnou náchylností k tvorbě π-komplexů se označují jako π-kyseliny.[16]
Zlatné komplexy alkenů a alkynů jsou elektrofilní a náchylné k nukleofilním atakům. Při oxymerkuracích se vzniklé organické sloučeniny rtuti vytvářejí stechiometricky a k získání konečného produktu je třeba další reakční krok. U zlata se protonolýzou vazeb Au-C bond katalytický cyklus uzavírá, což umožňuje koordinaci dalšího substrátu. K výhodám zlatných katalyzátorů patří: 1) stálost na vzduchu (způsobená vysokým oxidačním potenciálem Au+), 2) odolnost vůči vlhkosti a 3) nízká toxicita oproti ostatním π-kyselinám (jako jsou příslušné platnaté a rtuťnaté sloučeniny). Zlatné komplexy obvykle nejsou oxidovány a jejich alkylové a vinylové varianty nepodléhají beta-hydridovým eliminacím.[17]
Historie
[editovat | editovat zdroj]V roce 1976 byla popsána přeměna fenylacetylenu na acetofenon s použitím kyseliny tetrachlorozlatité; výtěžnost činila 37 %.[18] Trojmocné zlato zde sloužilo jako homogenní katalyzátor při reakci podobné oxymerkuraci.
V roce 1991 dal K. Utimoto tetrachlorzlatitan sodný (NaAuCl4) s alkyny a vodou.[19] J. H. Teles objevil nevýhodu tohoto postupu spočívající v redukci Au3+ na katalyticky neaktivní kovové zlato a roku 1998 použil pro stejnou reakci zlatný komplex:[20]
Tato reakce ukázala možnost dosáhnout u reakcí katalyzovaných zlatem vysoké účinnosti a vedla k výzkumu využití zlatných komplexů fosfinů v aktivacích násobných vazeb C-C.[21]
Kvůli nízké stabilitě zlatitých komplexů při podmínkách reakcí byla také zkoumána katalytická aktivita samotného chloridu zlatitého, který se v některých případech také ukázal jako dobrý katalyzátor, například byla popsána vnitromolekulární Dielsova–Alderova reakce, katalyzovaná AuCl3, alkynovaného furanu - druh reakce, jenž obvykle neprobíhá - za účelem přípravy 2,3-disubstituovaných fenolů:[22]
Mechanistické studie ukázaly, že na začátku této reakce proběhne hydroarylace alkynu, po které následuje několik vnitromolekulárních přesmyků a nakonec se objeví 6π elektrocyklizace a rearomatizace.
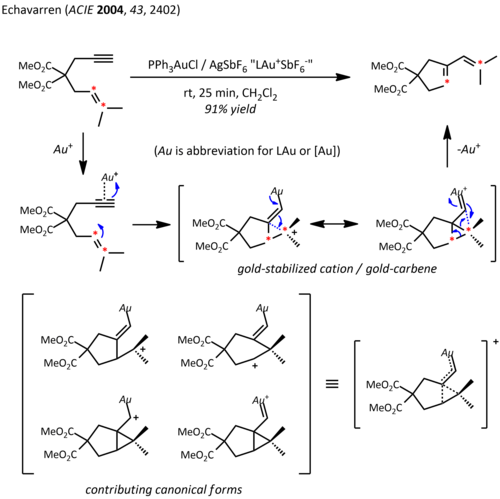
Velký náboj jádra atomu zlata (Z = 79) u jeho organických sloučenin způsobuje významné relativistické efekty. V důsledku relativistického rozšíření 5d-orbitalů může LAu fragment stabilizovat sousední karbokation dodáváním elektronů do prázdného p-orbitalu. Spolu s očekávanou reaktivitou karbokationtu se tak tyto kationty chovají jako karbeny, což bylo například využito v katalyzátorech cyklopropanací.[23]
Propargylestery mohou sloužit jako prekurzory kationtových vinylkarben-zlatných meziproduktů, schopných reagovat s alkeny v cyklopropanacích. Použití chirálního ligandu ((R)-DTBM-SEGPHOS) vedlo k dobrým až velmi dobrým enantioselektivitám.[24]


Antonio M. Echavarren popsal v roce 2005 první přípravu chirálních bisfosfinzlatných komplexů pro enantioselektivní reakce probíhající přes pí-aktivace,[25] ovšem již v roce 1986 se objevil článek o enantioselektivní katalýze sloučeninami zlata.[26] Benzaldehyd reagoval s methylisokyanoacetátem za přítomnosti chirálního ferrocenylfosfinového ligandu a bis(isokyanid)zlatného komplexu za cyklizace a vzniku chirálního oxazolinu. Protože oxazoliny lze hydrolyzovat na 1,2-aminoalkoholy, tak byla tato reakce jednou z prvních asymetrických katalytických adolových reakcí.
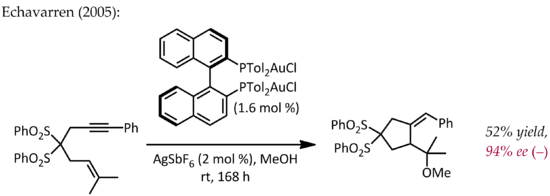
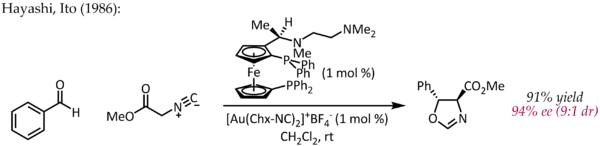
Na rozdíl od ostatních výše popsaných reakcí zde nebyla použita aktivace dvojné nebo trojné vazby C-C. Jednomocné se koordinovalo s fosfinovými ligandy a isokyanatanovou skupinou,[27] která byla poté atakována karbonylovou.
Heterogenní katalýza sloučeninami zlata je známa déle. Zlato je odolné vůči oxidacím a vykazuje vysokou účinnost při nízkoteplotních oxidacích a hydrochloraci acetylenů na vinylchloridy. Přesné vlastnosti katalytického místa u těchto reakcí nejsou známy.[28]
Ke katalyzování takovýchto reakcí lze použít i jiné kovy, například železo (viz organické sloučeniny železa).
Příklady reakcí katalyzovaných sloučeninami zlata
[editovat | editovat zdroj]Přestože nemají průmyslové využití, tak zlato může katalyzovat řadu organických reakcí, například zlatné sloučeniny lze použít na tvorbu vazeb C-C a zlatité sloučeniny, které jsou tvrdšími Lewisovými kyselinami, na vazby C-X (X = O, N). Zlato může dobře katalyzovat C-C a C-heteroatomové párovací reakce probíhající přes cykly obsahující zlatné a zlatité meziprodukty.[29]
Hong C. Shen rozdělil homogenní reakce vytvářející cyklické sloučeniny do čtyř skupin:[30]
- Nukleofilní adice heteroatomů na nenasycené vazby C-C, vytvářející převážně malé heterocykly (furany, pyrroly a thiofeny)
- Hydroarylace: Friedelovy–Craftsovy reakce s využitím komplexů kovů s alkyny, příkladem může být reakce mesitylenu s fenylacetylenem:[31]

- Cyklizace enynů, obzvláště cykloizomerizace, jako je 5-exo-dig-1,6-enynová cykloizomerizace:[32]
- Cykloadice, například reakce nitriloxidů s alkyny.[33]
Zlato je též možné použít při aktivacích vazeb C–H,[34] aldolových a párovacích reakcí.[35]
Omezení
[editovat | editovat zdroj]Přestože hydrofunkcionalizace alkynů, allenů a allylalkoholů katalyzované sloučeninami zlata probíhají dobře i za mírných podmínek,[36] tak neaktivované alkeny většinou tak dobře nereagují,[37] což je převážně způsobeno odolností alkylzlatných komplexů proti protodeauraci.[38]
Mezimolekulární reakce katalyzované zlatem nejsou tak rozvinuté jako vnitromolekulární.[39]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Organogold chemistry na anglické Wikipedii.
- ↑ a b Elschenbroich, C. and Salzer, A. (1992) Organometallics : A Concise Introduction. Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- ↑ a b R. V. Parish. Organogold chemistry: II reactions. Gold Bulletin. 1997, s. 55–62. doi:10.1007/BF03214757.
- ↑ a b R. V. Parish. Organogold chemistry: III applications. Gold Bulletin. 1998, s. 14–21. doi:10.1007/BF03215470.
- ↑ J. A. Mathews; L. L. Watters. The Carbide of Gold. Journal of the American Chemical Society. 2002-05-01, s. 108–111. Dostupné online. doi:10.1021/ja02040a010.
- ↑ Hubert Schmidbaur; Annette Schier. Aurophilic interactions as a subject of current research: an up-date. Chemical Society Reviews. 2011-12-05, s. 370–412. ISSN 1460-4744. doi:10.1039/C1CS15182G. PMID 21863191.
- ↑ X. B. Wang; Y. L. Wang; J. Yang; X. P. Xing; J. Li; L. S. Wang. Evidence of Significant Covalent Bonding in Au(CN)2−. Journal of the American Chemical Society. 2009, s. 16368–16370. doi:10.1021/ja908106e. PMID 19860420.
- ↑ M. S. Kharasch; Horace S. Isbell. The Chemistry of Organic Gold Compounds. III. Direct Introduction of Gold into the Aromatic Nucleus. Journal of the American Chemical Society. 1931-08-01, s. 3053–3059. ISSN 0002-7863. doi:10.1021/ja01359a030.
- ↑ Gary W. Rice; R. Stuart Tobias. Synthesis of tetramethylaurate(III). Structures of lithium dimethylaurate and lithium tetramethylaurate in solution. Inorganic Chemistry. 1975-10-01, s. 2402–2407. ISSN 0020-1669. doi:10.1021/ic50152a020.
- ↑ Gold catalysis for organic synthesis F. Dean Toste (Editor) [1] Beilstein Journal of Organic Chemistry
- ↑ H. G. Raubenheimer; H. Schmidbaur. The Late Start and Amazing Upswing in Gold Chemistry. Journal of Chemical Education. 2014, s. 2024–2036. doi:10.1021/ed400782p. Bibcode 2014JChEd..91.2024R.
- ↑ Beatrice Ranieri; Imma Escofet; Antonio M. Echavarren. Anatomy of gold catalysts: facts and myths. Organic and Biomolecular Chemistry. 2015-06-24, s. 7103–7118. ISSN 1477-0539. doi:10.1039/c5ob00736d. PMID 26055272.
- ↑ Yi-Ming Wang; Aaron D. Lackner; F. Dean Toste. Development of Catalysts and Ligands for Enantioselective Gold Catalysis. Accounts of Chemical Research. 2013-11-14, s. 889–901. doi:10.1021/ar400188g. PMID 24228794.
- ↑ Alexander Zhdanko; Martin E. Maier. Explanation of "Silver Effects" in Gold(I)-Catalyzed Hydroalkoxylation of Alkynes. ACS Catalysis. 2015-09-09, s. 5994–6004. doi:10.1021/acscatal.5b01493.
- ↑ Anna Homs; Imma Escofet; Antonio M. Echavarren. On the Silver Effect and the Formation of Chloride-Bridged Digold Complexes. Organic Letters. 2013, s. 5782–5785. doi:10.1021/ol402825v. PMID 24195441.
- ↑ Dawei Wang, Rong Cai, Sripadh Sharma, James Jirak, Sravan K. Thummanapelli, Novruz G. Akhmedov, Hui Zhang, Xingbo Liu, Jeffrey L. Petersen. "Silver Effect" in Gold(I) Catalysis: An Overlooked Important Factor. Journal of the American Chemical Society. 2012-05-18, s. 9012–9019. doi:10.1021/ja303862z. PMID 22563621.
- ↑ A. Fürstner; P. W. Davies. Catalytic Carbophilic Activation: Catalysis by Platinum and Gold π Acids. Angewandte Chemie International Edition. 2007, s. 3410–3449. doi:10.1002/anie.200604335. PMID 17427893.
- ↑ H. C. Shen. Recent advances in syntheses of heterocycles and carbocycles via homogeneous gold catalysis. Part 1: Heteroatom addition and hydroarylation reactions of alkynes, allenes, and alkenes. Tetrahedron. 2008, s. 3885–3903. doi:10.1016/j.tet.2008.01.081.
- ↑ R. O. C. Norman; W. J. E. Parr; C. B. Thomas. The reactions of alkynes, cyclopropanes, and benzene derivatives with gold(III). Journal of the Chemical Society, Perkin Transactions 1. 1976, s. 1983. doi:10.1039/P19760001983.
- ↑ Y. Fukuda; K. Utimoto. Effective transformation of unactivated alkynes into ketones or acetals with a gold(III) catalyst. The Journal of Organic Chemistry. 1991, s. 3729–3731. doi:10.1021/jo00011a058.
- ↑ J. H. Teles; S. Brode; M. Chabanas. Cationic Gold(I) Complexes: Highly Efficient Catalysts for the Addition of Alcohols to Alkynes. Angewandte Chemie International Edition. 1998, s. 1415–1418. doi:10.1002/(SICI)1521-3773(19980605)37:10<1415::AID-ANIE1415>3.0.CO;2-N. PMID 29710887.
- ↑ W. A. Nugent. "Black Swan Events" in Organic Synthesis. Angewandte Chemie International Edition. 2012, s. 8936–8949. doi:10.1002/anie.201202348. PMID 22893229.
- ↑ A. S. K. Hashmi; T. M. Frost; J. W. Bats. Highly Selective Gold-Catalyzed Arene Synthesis. Journal of the American Chemical Society. 2000, s. 11553-11554. doi:10.1021/ja005570d.
- ↑ David J. Gorin; F. Dean Toste. Relativistic effects in homogeneous gold catalysis. Nature. 2007, s. 395–403. doi:10.1038/nature05592. PMID 17377576. Bibcode 2007Natur.446..395G.
- ↑ Magnus J. Johansson; David J. Gorin; Steven T. Staben; F. Dean Toste. Gold(I)-Catalyzed Stereoselective Olefin Cyclopropanation. Journal of the American Chemical Society. 2005-11-30, s. 18002-18003. doi:10.1021/ja0552500. PMID 16366541.
- ↑ M. Paz Muñoz; Javier Adrio; Juan Carlos Carretero; Antonio M. Echavarren. Ligand Effects in Gold- and Platinum-Catalyzed Cyclization of Enynes: Chiral Gold Complexes for Enantioselective Alkoxycyclization. Organometallics. 2005-02-12, s. 1293–1300. doi:10.1021/om0491645.
- ↑ Y. Ito; M. Sawamura; T. Hayashi. Catalytic asymmetric aldol reaction: Reaction of aldehydes with isocyanoacetate catalyzed by a chiral ferrocenylphosphine-gold(I) complex. Journal of the American Chemical Society. 1986, s. 6405–6406. doi:10.1021/ja00280a056.
- ↑ A. Togni; S. D. Pastor. Chiral cooperativity: The nature of the diastereoselective and enantioselective step in the gold(I)-catalyzed aldol reaction utilizing chiral ferrocenylamine ligands. The Journal of Organic Chemistry. 1990, s. 1649–1664. doi:10.1021/jo00292a046.
- ↑ G. J. Hutchings; M. Brust; H. Schmidbaur. Gold—an introductory perspective. Chemical Society Reviews. 2008, s. 1759–1765. doi:10.1039/b810747p. PMID 18762825.
- ↑ A. Nijamudheen; Ayan Datta. Gold‐Catalyzed Cross‐Coupling Reactions: An Overview of Design Strategies, Mechanistic Studies, and Applications. Chemistry: A European Journal. 2020, s. 1442–1487. doi:10.1002/chem.201903377. PMID 31657487.
- ↑ H. C. Shen. Recent advances in syntheses of carbocycles and heterocycles via homogeneous gold catalysis. Part 2: Cyclizations and cycloadditions. Tetrahedron. 2008, s. 7847–7870. doi:10.1016/j.tet.2008.05.082.
- ↑ M. T. Reetz; K. Sommer. Gold-Catalyzed Hydroarylation of Alkynes. European Journal of Organic Chemistry. 2003, s. 3485–3496. doi:10.1002/ejoc.200300260.
- ↑ C. Nieto-Oberhuber; M. P. Muñoz; E. Buñuel; C. Nevado; D. J. Cárdenas; A. M. Echavarren. Cationic Gold(I) Complexes: Highly Alkynophilic Catalysts for the exo- andendo-Cyclization of Enynes. Angewandte Chemie International Edition. 2004, s. 2402–2406. doi:10.1002/anie.200353207. PMID 15114573.
- ↑ F. Gasparrini; M. Giovannoli; D. Misiti; G. Natile; G. Palmieri; L. Maresca. Gold(III)-catalyzed one-pot synthesis of isoxazoles from terminal alkynes and nitric acid. Journal of the American Chemical Society. 1993, s. 4401–4402. doi:10.1021/ja00063a084.
- ↑ A. Hoffmann-Röder; N. Krause. The golden gate to catalysis. Organic & Biomolecular Chemistry. 2005, s. 387–391. doi:10.1039/b416516k. PMID 15678171.
- ↑ H. A. Wegner; M. Auzias. Gold for C-C coupling reactions: a Swiss-Army-knife catalyst?. Angewandte Chemie International Edition. 2011, s. 8236–8247. doi:10.1002/anie.201101603. PMID 21818831.
- ↑ Marco Bandini. Allylic Alcohols: Sustainable Sources for Catalytic Enantioselective Alkylation Reactions. Angewandte Chemie International Edition. 2011-02-01, s. 994–995. ISSN 1521-3773. doi:10.1002/anie.201006522. PMID 21268189.
- ↑ Zhibin Zhang; Seong Du Lee; Ross A. Widenhoefer. Intermolecular Hydroamination of Ethylene and 1-Alkenes with Cyclic Ureas Catalyzed by Achiral and Chiral Gold(I) Complexes. Journal of the American Chemical Society. 2009-04-22, s. 5372–5373. ISSN 0002-7863. doi:10.1021/ja9001162. PMID 19326908.
- ↑ Rebecca L. LaLonde; William E. Brenzovich; Diego Benitez; Ekaterina Tkatchouk; Kotaro Kelley; William A. Goddard; F. Dean Toste. Alkylgold complexes by the intramolecular aminoauration of unactivated alkenes. Chemical Science. 2010, s. 226. doi:10.1039/C0SC00255K. PMID 24358445.
- ↑ Michael E. Muratore; Anna Homs; Carla Obradors; Antonio M. Echavarren. Meeting the Challenge of Intermolecular Gold(I)-Catalyzed Cycloadditions of Alkynes and Allenes. Chemistry: An Asian Journal. 2014-11-01, s. 3066–3082. ISSN 1861-471X. doi:10.1002/asia.201402395. PMID 25048645.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Organické sloučeniny zlata na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organické sloučeniny zlata na Wikimedia Commons