Acetylidy
Acetylidy jsou organické sloučeniny s obecnými vzorci MC≡CH a MC≡CM, kde M je atom kovu.[1] Toto označení se také používá pro substituované acetylidy, RC≡CM, kde R je organická funkční skupina.
Acetylidy se používají jako reaktanty v organické syntéze.
Nejvýznamnější sloučeninou z této skupiny je acetylid vápenatý, obvykle nazývaný karbid vápenatý.
Struktura
[editovat | editovat zdroj]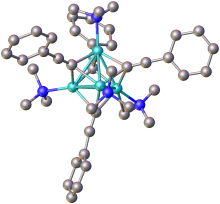
Acetylidy alkalických kovů a kovů alkalických zemin s obecným vzorcem MC≡CM jsou sloučeniny podobné solím, jež obsahují ionty C 2−
2 . Jejich iontová povaha se projevuje snadnou hydrolýzou na acetylen a oxidy kovů; ionty C 2−
2 jsou také rozpustné v kapalném amoniaku.[3]
Základní stav C 2−
2 má uzavřenou elektronovou slupku 1Σ +
g , v důsledku čehož je izoelektronický s neutrální molekulou N2,[4] který jej částečně stabilizuje.
Podobné acetylidy jiných, hlavně přechodných, kovů (například acetylid stříbrný a měďný) jsou kovalentní a acetylidové ionty jsou na kovy navázané pevně, což se projevuje na jejich stabilitě vůči vodě a odlišnými chemickými vlastnostmi.
Acetylidy druhu RC≡CM (R = H nebo alkyl) mívají podobné vlastnosti jako příslušné dvojnásobně substituované sloučeniny. Za nepřítomnosti dalších ligandů vykazují tyto acetylidy polymerní struktury, ve kterých jsou acetylidové skupiny můstkovými ligandy.
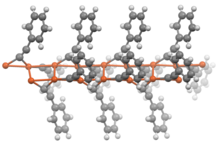
Příprava
[editovat | editovat zdroj]Koncové alkyny jsou slabými kyselinami:[6]
- RC≡CH + R″M ⇌ R″H + RC≡CM
K přípravě acetylidů z acetylenu a dalších alkynů se používají organokovové[7] nebo anorganické superzásady[8] v rozpouštědlech méně kyselých než příslušný alkyn. Původně byl používán kapalný amoniak, ovšem běžnější jsou ethery.
Amid lithný,[6] bis(trimethylsilyl)amid lithný[9] a organolithné sloučeniny, jako například butyllithium,[7] lze použít na tvorbu lithných acetylidů:
Sodné a draselné acetylidy se dají získat z mnoha různých anorganických sloučenin, například amidu sodného[8] nebo z kovů, často i za pokojové teploty a atmosférického tlaku.[6]
Acetylid měďný je možné připravit průchodem acetylenu vodným roztokem chloridu měďného, protože má tato sloučenina nízký součin rozpustnosti.[6] Podobným způsobem lze z dusičnanu stříbrného vytvořit acetylid stříbrný.
Acetylid vápenatý se vyrábí reakcí uhlíku s oxidem vápenatým při teplotě okolo 2 000 °C., podobně probíhá i výroba acetylidu lithného.
Reakce a použití
[editovat | editovat zdroj]Acetylidy typu RC2M se používají v alkynylačních reakcích jako nukleofily, které se navazují na elektrofilní a nenasycené substráty; příkladem využití je Favorského reakce.
Ethylpropiolát je deprotonován n-butyllithem na acetylid. Tento acetylid se aduje na karbonylovou skupinu cyklopentanonu. Hydrolýzou poté vznikne alkynylalkohol.[10]

Párovací reakce
[editovat | editovat zdroj]Acetylidy jsou reaktivními meziprodukty některých párovacích reakcí, například Sonogaširovy, Cadiotovy–Chodkiewiczovy, Glaserovy a Eglintonovy.
Bezpečnost
[editovat | editovat zdroj]Některé acetylidy jsou výbušné.[11]
Příprava acetylidů může být nebezpečná kvůli nakládání s plynným acetylenem za přítomnosti kovů, jako jsou rtuť, stříbro či měď, nebo slitin, které je obsahují (mosazi, bronzu, stříbrné pájky).
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Acetylidy na Wikimedia Commons
Obrázky, zvuky či videa k tématu Acetylidy na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Acetylide na anglické Wikipedii.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.a00067. (anglicky) DOI: 10.1351/goldbook.
- ↑ Bernd Schubert; Erwin Weiss. (PHCCLi)4(tmhda)2, A Polymeric Organolithium Compound with Cubic Li4C4 Structural Units. Angewandte Chemie International Edition in English. 1983, s. 496–497. DOI 10.1002/anie.198304961.
- ↑ Markus Hamberger; Stefan Liebig; Ute Friedrich; Nikolaus Korber; Uwe Ruschewitz. Evidence of Solubility of the Acetylide Ion C 2−
2 : Syntheses and Crystal Structures of K2C2·2 NH3, Rb2C2·2 NH3, and Cs2C2·7 NH3. Angewandte Chemie International Edition. 2012-12-21, s. 13006–13010. DOI 10.1002/anie.201206349. PMID 23161511. - ↑ T. Sommerfeld; U. Riss; H.-D. Meyer; L. Cederbaum. Metastable C 2−
2 dianion. Physical Review Letters. 1997, s. 1237–1240. DOI 10.1103/PhysRevLett.79.1237. Bibcode 1997PhRvL..79.1237S. - ↑ Stephen S. Y. Chui; Miro F. Y. Ng; Chi-Ming Che. Structure Determination of Homoleptic AuI, AgI, and CuI Aryl/Alkylethynyl Coordination Polymers by X-ray Powder Diffraction. Chemistry: A European Journal. 2005, s. 1739–1749. DOI 10.1002/chem.200400881. PMID 15669067.
- ↑ a b c d Heinz Günter Viehe. Chemistry of Acetylenes. Angewandte Chemie. 1969, s. 170–179 & 225–241. Dostupné online. DOI 10.1002/ange.19720840843.
- ↑ a b M. M. Midland; J. I. McLoughlin; T. Ralph. Preparation and Use of Lithium Acetylide: 1-Methyl-2-ethynyl-endo-3,3-dimethyl-2-norbornanol. Organic Syntheses. 1990, s. 14. DOI 10.15227/orgsyn.068.0014.
- ↑ a b Donald D. Coffman. Dimethylethhynylcarbinol. Organic Syntheses. 1940, s. 20. DOI 10.15227/orgsyn.020.0040.
- ↑ Melanie Reich. Addition of a lithium acetylide to an aldehyde; 1-(2-pentyn-4-ol)-cyclopent-2-en-1-ol. ChemSpider Synthetic Pages. 2001-08-24, s. 137. DOI 10.1039/SP137.
- ↑ M. Mark Midland; Alfonso Tramontano; John R. Cable. Synthesis of alkyl 4-hydroxy-2-alkynoates. The Journal of Organic Chemistry. 1980, s. 28–29. DOI 10.1021/jo01289a006.
- ↑ Franco Cataldo; Carlo S. Casari. Synthesis, Structure and Thermal Properties of Copper and Silver Polyynides and Acetylides. Journal of Inorganic and Organometallic Polymers and Materials. 2007, s. 641–651. ISSN 1574-1443. DOI 10.1007/s10904-007-9150-3.

![{\displaystyle {\ce {{H-C{\equiv }C-H}+{\overset {butyllithium}{BuLi}}->[{\ce {THF}}][-78^{\circ }{\ce {C}}]{Li-\!{\equiv }\!-H}+BuH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7f2a31939e76759509d17aec8c45e1c46780193c)