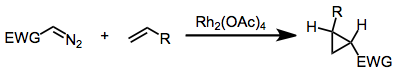Cyklopropanace
Cyklopropanace jsou chemické reakce, při kterých se vytvářejí cyklopropanové kruhy. Jedná se o významnou skupinu reakcí, protože tuto funkční skupinu obsahuje řada důležitých látek, jako jsou pyrethroidy a řada chinolonových antibiotik (například ciprofloxacin a sparfloxacin). Velké úhlové napětí u cyklopropanů ovšem jejich syntézu ztěžuje a způsobuje potřebu použití vysoce reaktivních reaktantů, jako jsou například karbeny, ylidy a karboanionty.[1]
Řada těchto reakcí probíhá cheletropně.

Způsoby provedení
[editovat | editovat zdroj]Z alkenů s použitím karbenoidových reaktantů
[editovat | editovat zdroj]Existuje několik způsobů přeměny alkenů na cyklopropany pomocí karbenů. Protože jsou karbeny velmi reaktivní, tak se obvykle používají ve stabilizované podobě, kde jsou označovány jako karbenoidy.[2]
Simmonsova–Smithova reakce
[editovat | editovat zdroj]V Simmonsově–Smithově reakci je reaktivním karbenoidem jodmethyljodid zinečnatý, obvykle vytvářený reakcí dijodmethanu se slitinou zinku a mědi (Zn-Cu). K tvorbě karbenoidů lze také použít jiné látky, například dibrommethan[3] nebo diazomethan a jodid zinečnatý.[4] Reaktivitu lze také zvýšit použitím diethylzinku místo Zn-Cu.[5]
Byly popsány i asymetrické cyklopropanace.[6]
Z diazosloučenin
[editovat | editovat zdroj]Některé diazosloučeniny, například diazomethan, mohou ve dvou krocích reagovat s alkeny za vzniku cyklopropanů. První krok spočívá v 1,3-dipolární cykloadici za tvorby pyrazolinů, jež jsou následně fotochemicky nebo tepelně denitrogenovány na cyklopropany. Tepelný rozklad, při kterém se často používají jako katalyzátory hydroxid draselný a platina, bývá rovněž označován jako Kishnerova syntéza cyklopropanů;[7] lze při něm také použít hydrazin a α,β-nenasycené karbonylové sloučeniny.[8]
Mechanismus rozkladu byl předmětem několika studií a stále není plně prozkoumán, předpokládá se však, že reakce probíhají přes diradikálové meziprodukty.[9][10]
Tento postup je oproti ostatním karbenovým cyklopropanacím šetrnější k životnímu prostředí, protože se při něm nepoužívají kovy nebo halogenovaná činidla a vedlejším produktem je pouze plynný dusík. Může být ovšem nebezpečný, protože stopová množství nezreagovaných diazosloučenin mohou během tepelného přesmyku pyrazolinu vybouchnout.
Pomocí diazosloučenin a kovových katalyzátorů
[editovat | editovat zdroj]Methylfenyldiazoacetát a jiné podobné diazosloučeniny mohou sloužit jako prekurzory donor-akceptorových karbenů, které lze použít na cyklopropanace nebo je navazovat na vazby C-H v organických substrátech. Tyto reakce mohou být katalyzovány octanem rhodnatým nebo i chirálními sloučeninami.[11][12][13]
Z volných karbenů
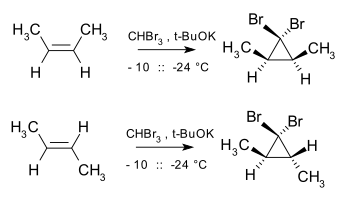
[editovat | editovat zdroj]Volné karbeny lze také použít k cyklopropanacím, jejich využití tímto způsobem je ale omezené, protože jen málo jich lze dobře připravit a téměř všechny jsou nestálé (například u nich dochází k dimerizaci); výjimku tvoři dihalokarbeny, například dichlorkarben nebo difluorkarben, které jsou stabilnější a vytváří geminální dihalocyklopropany.[14]
Tyto sloučeniny lze použít na tvorbu allenů Skattebølovým přesmykem.
Stablizované karbeny též vznikají při Buchnerových reakcích.
Cyclopropanace bývají stereospecifické, protože adice karbenů a karbenoidů na alkeny patří mezi cheletropní syn-adice; například dibromkarben a cis-but-2-en vytváří cis-2,3-dimethyl-1,1-dibromcyklopropan, zatímco trans izomer vede výhradně k trans-produktu.[15]
Z alkenů pomocí ylidů
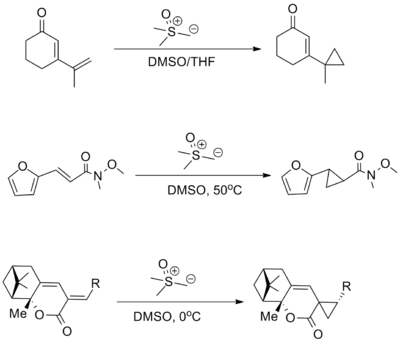
[editovat | editovat zdroj]Cyklopropany lze připravit s využitím sirných ylidů pomocí Johnsonovy–Coreyovy–Čajkovského reakce,[16] tento proces je ovšem omezen pouze na alkeny chudé na elektrony, hlavně na α,β-nenasycené karbonylové sloučeniny.
Vnitromolekulární cyklizace
[editovat | editovat zdroj]Cyklopropany je možné získat i řadou vnitromolekulárních cyklizací. Jednu z možností představuje použití primárních halogenalkanů s vhodně umístěnými skupinami odtahujícími elektrony. Působením silné zásady se vytvoří karboanion, jenž se následně cyklizuje za odštěpení halogenidu. Jako příklady lze uvést přípravu cyklopropankarbonitrilu[17] a cyklopropylacetylenu.[18] Tento mechanismus je také základem Favorského přesmyku.
Podobným dějem je cyklizace 1,3-dibrompropanu Wurtzovou reakcí. Takto provedl v roce 1881 August Freund přípravu cyklopropanu. Původně byl použit sodík,[19] ovšem při jeho nahrazení zinkem lze dosáhnout lepšího výtěžku.[20]
- BrCH2CH2CH2Br + 2 Na → (CH2)3 + 2 NaBr
Další postupy
[editovat | editovat zdroj]- Při Kulinkovičových reakcích vznikají cyklopropanoly reakcemi esterů s Grignardovými činidly za přítomnosti titaničitých alkoxidů.
- Bingelova reakce je reakce sloužící k cyklopropanacím fullerenů.
- Při di-pí methanových přesmycích dochází k fotochemickým přesmykům 1,4-dienů na vinylcyklopropany, které následně mohou projít vinylcyklopropanovými přesmyky
Biosyntéza
[editovat | editovat zdroj]
I když se cyklopropany v živých organismech objevují vzácně, tak byla objevena řada biocyklopropanačních metabolických drah; nejčastější je karbokationtové uzavírání kruhů u izoprenoidů. Cyklopropanové mastné kyseliny vznikají ataky S-adenosylmethioninu (SAM) na nenasycené mastné kyseliny. Prekurzor ethenu jako hormonu, kyselina 1-aminocyklopropan-1-karboxylová, vzniká přímo z SMM vnitromolekulární nukleofilní substitucí SMe2 skupiny po kondenzaci s pyridoxalfosfátem.[21]
In vitro biokatalýzou pomocí upraveného cytochromu P450 z Bacillus megaterium bylo dosaženo přímých přesunů karbenů z diazoesterů na alkeny.[22]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Cyclopropanation na anglické Wikipedii.
- ↑ Hélène Pellissier. Recent developments in asymmetric cyclopropanation. Tetrahedron. 2008, s. 7041–7095. Dostupné online. DOI 10.1016/j.tet.2008.04.079.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.c00813. (anglicky) DOI: 10.1351/goldbook.
- ↑ Bodo Fabisch; Terence N. Mitchell. An inexpensive modification of the Simmons-Smith reaction: The formation of bromomethylzinc bromide as studied by NMR spectroscopy. Journal of Organometallic Chemistry. 1984, s. 219–221. DOI 10.1016/0022-328X(84)80305-8.
- ↑ Georg Wittig; Frank Wingler. Über methylenierte Metallhalogenide, IV. Cyclopropan-Bildung aus Olefinen mit Bis-halogenmethyl-zink. Chemische Berichte. 1964-08-01, s. 2146–2164. DOI 10.1002/cber.19640970808.
- ↑ J. Furukawa; N. Kawabata; J. Nishimura. Synthesis of cyclopropanes by the reaction of olefins with dialkylzinc and methylene iodide. Tetrahedron. 1968, s. 53–58. DOI 10.1016/0040-4020(68)89007-6.
- ↑ A. B. Charette; A. Beauchemin. Simmons-Smith Cyclopropanation reaction. Organic Reactíons. 2001, s. 1. ISBN 978-0471264187. DOI 10.1002/0471264180.or058.01.
- ↑ David E. Lewis. Disability, Despotism, Deoxygenation-From Exile to Academy Member: Nikolai Matveevich Kizhner. Angewandte Chemie International Edition. 2013-11-04, s. 11704-11712. DOI 10.1002/anie.201303165. PMID 24123691.
- ↑ R. J. Petersen; P. P. S. Skell. PHENYLCYCLOPROPANE. Organic Syntheses. 1967, s. 98. DOI 10.15227/orgsyn.047.0098.
- ↑ Robert J. Crawford; Anupama Mishra. The Mechanism of the Thermal Decomposition of 1-Pyrazolines and Its Relationship to Cyclopropane Isomerizations. Journal of the American Chemical Society. 1966, s. 3963–3969. DOI 10.1021/ja00969a014.
- ↑ Elena Muray; Ona Illa; José A. Castillo; Ángel Álvarez-Larena; José L. Bourdelande; Vicenç Branchadell; Rosa M. Ortuño. Photolysis of Chiral 1-Pyrazolines to Cyclopropanes: Mechanism and Stereospecificity. The Journal of Organic Chemistry. 2003, s. 4906–4911. DOI 10.1021/jo0342471. PMID 12790598.
- ↑ H. M. L. Davies; D. Morton. Guiding Principles for Site Selective and Stereoselective Intermolecular C–H Functionalization by Donor/Acceptor Rhodium Carbenes. Chemical Society Reviews. 2011, s. 1857–1869. DOI 10.1039/C0CS00217.
- ↑ Huw M. L. Davies; Wen‐hao Hu; Dong Xing. Methyl Phenyldiazoacetate. EEROS. 2015, s. 1–10. ISBN 9780470842898. DOI 10.1002/047084289X.rn00444.pub2.
- ↑ Hélène Lebel; Jean-François Marcoux; Carmela Molinaro; André B. Charette. Stereoselective Cyclopropanation Reactions. Chemical Reviews. 2003-04-01, s. 977–1050. DOI 10.1021/cr010007e. PMID 12683775.
- ↑ Michał Fedoryński. Syntheses of Dihalocyclopropanes and Their Use in Organic Synthesis. Chemical Reviews. 2003-04-01, s. 1099–1132. DOI 10.1021/cr0100087. PMID 12683778.
- ↑ P. S. Skell; A. Y. Garner. The Stereochemistry of Carbene-Olefin Reactions. Reactions of Dibromocarbene with the cis- and trans-2-Butenes. Journal of the American Chemical Society. 1956, s. 3409–3411. DOI 10.1021/ja01595a040.
- ↑ A.-H. Li; L.-X. Dai; V. K. Aggarwal. Asymmetric Ylide Reactions: Epoxidation, Cyclopropanation, Aziridination, Olefination, and Rearrangement. Chemical Reviews. 1997, s. 2341. DOI 10.1021/cr960411r.
- ↑ SCHLATTER, M. J. Cyclopropyl Cyanide. Org. Synth.. 1943, s. 20. Dostupné online. DOI 10.15227/orgsyn.023.0020.; Coll. Vol.. S. 223.
- ↑ HUNTINGTON, Martha; CORLEY, Edward G.; THOMPSON, Andrew S. Cyclopropylacetylene. Org. Synth.. 2000, s. 231. Dostupné online. DOI 10.15227/orgsyn.077.0231.
- ↑ August Freund. Über Trimethylen. Journal für Praktische Chemie. 1881, s. 625–635. Dostupné online. DOI 10.1002/prac.18820260125.
- ↑ G. Gustavson. Ueber eine neue Darstellungsmethode des Trimethylens. Journal für Praktische Chemie. 1887, s. 300–305. Dostupné online. DOI 10.1002/prac.18870360127.
- ↑ Ludger A. Wessjohann; Wolfgang Brandt; Thies Thiemann. Biosynthesis and Metabolism of Cyclopropane Rings in Natural Compounds. Chemical Reviews. 2003, s. 1625–1648. DOI 10.1021/cr0100188. PMID 12683792.
- ↑ P. S. Coelho; E. M. Brustad; A. Kannan; F. H. Arnold. Olefin Cyclopropanation via Carbene Transfer Catalyzed by Engineered Cytochrome P450 Enzymes. Science. 2012-12-20, s. 307–310. Dostupné online. DOI 10.1126/science.1231434. PMID 23258409. Bibcode 2013Sci...339..307C.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Cyklopropanace na Wikimedia Commons
Obrázky, zvuky či videa k tématu Cyklopropanace na Wikimedia Commons