Organické sloučeniny arsenu
Organické sloučeniny arsenu jsou organické sloučeniny obsahující vazby mezi atomy arsenu a uhlíku. Několik se jich vyrábí průmyslově a má využití jako insekticidy, herbicidy a fungicidy. Takováto využívání organoarsenových sloučenin se omezují, protože poškozují životní prostředí i lidské zdraví.
Základními sloučeninami jsou zde arsan a kyselina arseničná. I přes toxicitu těchto sloučenin je známo několik organoarsenových biomolekul.
Historie
[editovat | editovat zdroj]I když jde v současnosti o málo zkoumanou oblast, tak měly organoarsenové sloučeniny významný vliv na rozvoj chemie. Nejstarší známá sloučenina z této skupiny, kakodyl, byla popsána roku 1760. Arsefenamin byl pod názvem salvarsan používán jako lék na syfilis, Paul Ehrlich za jeho objev získal Nobelovu cenu. Řada dalších organoarsenových sloučenin se používala jako antibiotka (Solarson) nebo jiné léky.[1]
Příprava a rozdělení
[editovat | editovat zdroj]Arsen ve sloučeninách obvykle zaujímá oxidační číslo III nebo V, což se projevuje například u halogenidů AsX3 (X = F, Cl, Br, I) a AsF5. Podobně je tomu i u jeho organických sloučenin.[2]
K hydroxysloučeninám arsenu patří:[2]
- kyseliny (RAs(OH)2), vzácné (kyselina arsenitá (As(OH)3) je dobře popsána)
- kyseliny R2AsOH, vzácné
- arsinové kyseliny (R2As(O)OH), běžné, například kyselina kakodylová (R = CH3)
- arsonové kyseliny (RAs(O)(OH)2), běžné, například kyselina fenylarsonová (R = C6H5)
Organoarseničné sloučeniny
[editovat | editovat zdroj]Arseničné sloučeniny nejčastěji obsahují funkční skupiny RAsO(OH)2 nebo R2AsO(OH) (R = alkyl nebo aryl). Metabolismus sloučenin arsenu začíná tvorbou methanarsonátů. Trojvazné sloučeniny arsenu jsou tak methylovány na methanarsonáty, zdrojem methylových skupin bývá S-adenosylmethionin. Methanarsonáty se dále přeměňují na dimethylarsonáty cyklem skládajícím se z redukce na kyselinu methylarsonovou a druhé methylace;[3] produktem je dimethylovaná sloučenina nazývaná kyselina kakodylová (CH3)2AsO2H), která má tak velký význam v rámci organoarsenových sloučenin. Odpovídající sloučenina fosforu, kyselina dimethylfosfonová, má v chemii fosforu menší význam. Kyselina kakodylová se vytváří methylací oxidu arsenitého. Fenylarsonové kyseliny lze připravit reakcí anilinů s kyselinou arseničnou, nazývanou Bechampova reakce.
Monomethylovaná kyselina, kyselina methanarsonová (CH3AsO(OH)2), je prekurzorem fungicidů používaných při pěstování rýže a bavlníku. Deriváty kyseliny fenylarsonové (C6H5AsO(OH)2), například kyseliny 4-hydroxy-3-nitrobenzenarsonová, ureidofenylarsonová a p-arsanilová, se přidávají do krmiv pro dobytek.
Arseničné sloučeniny obsahující pouze organické ligandy, jako například pentafenylová molekula As(C6H5)5, nejsou běžné.[4]
Organoarsenité sloučeniny
[editovat | editovat zdroj]Většina organoarsenitých sloučenin, jako jsou trimethylarsan ((CH3)3As), dimethylchlorarsan ((CH3)2AsCl) a methyldichlorarsan (CH3AsCl2), se připravuje alkylacemi AsCl3 a jeho derivátů organolithnými sloučeninami nebo Grignardovými činidly.[4] Redukcí chloridů hydridy vznikají příslušné hydridy arsenu, například dimethylarsan ((CH3)2AsH) a methylarsan (CH3AsH2). Podobné reakce lze provést i u ostatních chlororganoarsenových sloučenin.
Dimethylarsenité sloučeniny je možné získat redukcí kyseliny kakodylové:
- (CH3)2AsO2H + 2 Zn + 4 HCl → (CH3)2AsH + 2 ZnCl2 + 2 H2O
- (CH3)2AsO2H + SO2 + HI → (CH3)2AsI + SO3 + H2O
Je známo mnoho heterocyklů obsahujících arsen, například arsol, analog pyrrolu, a arsabenzen, analog pyridinu.
Symetrické organoarsenité sloučeniny, jako jsou například trimethylarsan a trifenylarsan, se často používají jako ligandy v koordinační chemii. Mají vlastnosti podobné fosfinovým ligandům, jsou však méně zásadité. Diarsan, C6H4(As(CH3)2)2,zkráceně diars, je chelatujícím ligandem. Thorin se používá k důkazu přítomnosti některých kovů.
Organoarsenné sloučeniny
[editovat | editovat zdroj]Menší využití mají organoarsenné sloučeniny, jako jsou léčiva na syfilis salvarsan a neosalvarsan. Obvykle obsahují tři vazby na As a jednu jednoduchou vazbu As-As. Arsenné sloučeniny s dvojnými vazbami As=As jsou ojedinělé.
Chemické zbraně
[editovat | editovat zdroj]Organické sloučeniny arsenu, obzvláště ty, které obsahují vazby As-Cl, byly používány jako chemické zbraně; příklady jsou lewisit (2-chlorvinyldichlorarsan), Clark I (chlordifenylarsan) a fenyldichlorarsan.
Výskyt v přírodě
[editovat | editovat zdroj]Arsen je pro většinu organismů toxický a v některých oblastech se vyskytuje ve zvýšených koncentracích, bylo tak vyvinuto několik postupů detoxifikace. Anorganický arsen a jeho sloučeniny se v organismech metabolizují na méně toxické formy methylací.[5]
Organické sloučeniny arsenu se vytvářejí z anorganických biomethylacemi,[6] řízenými enzymy souvisejícími s vitaminem B12;[7] například plíseň Scopulariopsis brevicaulis vytváří za přítomnosti anorganického arsenu významná množství trimethylarsanu.[8]
Sloučenina arsenobetain, druh betainu, byla u některých mořských ryb a řas nalezena, stejně jako u hub, ve vysokých koncentracích. Průměrný příjem arsenobetainu na osobu se pohybuje mezi 10 a 50 µg/den. Po konzumaci ryb a hub se mohou objevovat hodnoty okolo 1000 µg, nejsou však nebezpečné, protože je tato sloučenina jen málo toxická.[9]
Arsenobetain byl poprvé nalezen u langusty Panulirus cygnus.[10][11]
Sacharidy se mohou vázat na arsen a vytvářet tak sloučeniny nazývané arsenosacharidy; ty se nacházejí zejména v mořských řasách. Také jsou popsány lipidy obsahující arsen.[12]
Jedinou polyarsenovou sloučeninou izolovanou z přírodních zdrojů je arsenicin A, nalezený v mořské houbě Echinochalina bargibanti.[13]
Organoarsenové sloučeniny mohou mít rozdílnou toxicitu. Kyselina arsenitá (As(OH)3) má LD50 u myší 34,5 mg/kg, zatímco u betainu (CH3)3As+CH2CO2− převyšuje 10 g/kg.[9]
Příklady sloučenin
[editovat | editovat zdroj]Níže jsou uvedeny příklady organoarsenových sloučenin:
| Sloučenina | R | Molární hmotnost | Registrační číslo CAS | Vlastnosti | |
| 10,10'-oxybis-10H-fenoxarsan |  |
502,23 | 58-36-6 | ||
| Trifenylarsan | fenyl |  |
306,23 | 603-32-7 | teplota tání 58-61 °C |
| Fenyldichlorarsan | fenyl, chlor | 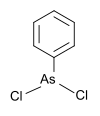 |
222,93 | 696-28-6 | |
| Roxarson | 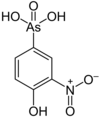 |
263,04 | 121-19-7 | ||
| Arsenobetain | 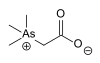 |
178,00 | 64436-13-1 | ||
| Arsenicin A |  |
389,76 | 925705-41-5 | teplota tání 182 až 184 °C | |
| Příklady organických sloučenin arsenu [14][13] | |||||
Názvosloví
[editovat | editovat zdroj]Názvosloví cyklických organických sloučenin arsenu je založeno na Hantzschově–Widmanově názvosloví:[15][16]
| Počet atomů v kruhu | Nenasycený kruh | Nasycený kruh |
|---|---|---|
| 3 | Arsiren | Arsiran |
| 4 | Arset | Arsetan |
| 5 | Arsol | Arsolan |
| 6 | Arsinin | Arsinan |
| 7 | Arsepin | Arsepan |
| 8 | Arsocin | Arsokan |
| 9 | Arsonin | Arsonan |
| 10 | Arsecin | Arsekan |
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Organoarsenic chemistry na anglické Wikipedii.
- ↑ Singh, R. Synthetic Drugs. Mittal Publications (2002) ISBN 817099831X
- ↑ a b GRUND, Sabina C.; HANUSCH, Kunibert; WOLF, Hans Uwe. Arsenic and Arsenic Compounds. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a03_113.pub2. S. a03_113.pub2. (anglicky) DOI: 10.1002/14356007.a03_113.pub2.
- ↑ M. Styblo, L. M. Del Razo, L. Vega, D. R. Germolec, E. L. LeCluyse, G. A. Hamilton, W. Reed, C. Wang, W. R. Cullen, D. J. Thomas. Comparative toxicity of trivalent and pentavalent inorganic and methylated arsenicals in rat and human cells. Archives of Toxicology. 2000, s. 289–299. doi:10.1007/s002040000134. PMID 11005674.
- ↑ a b Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ↑ K. J. Reimer; I. Koch; W. R. Cullen. Metal Ions in Life Sciences. Cambridge: RSC publishing, 2010. Dostupné online. ISBN 978-1-84755-177-1. doi:10.1039/9781849730822-00165. PMID 20877808. Kapitola Organoarsenicals. Distribution and transformation in the environment, s. 165–229.
- ↑ E. Dopp; A. D. Kligerman; R. A. Diaz-Bone. Metal Ions in Life Sciences. Cambridge: RSC publishing, 2010. Dostupné online. ISBN 978-1-84755-177-1. doi:10.1515/9783110436600-012. PMID 20877809. Kapitola Organoarsenicals. Uptake, metabolism and toxicity, s. 231–265.
- ↑ Toshikazu Kaise, Mitsuo Ogura, Takao Nozaki, Kazuhisa Saitoh, Teruaki Sakurai, Chiyo Matsubara, Chuichi Watanabe, Ken'ichi Hanaoka. Biomethylation of Arsenic in an Arsenic-rich Freshwater Environment. Applied Organometallic Chemistry. 1998, s. 297–304. doi:10.1002/(SICI)1099-0739(199704)11:4<297::AID-AOC584>3.0.CO;2-0.
- ↑ Ronald Bentley; Thomas G. Chasteen. Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth. Microbiology and Molecular Biology Reviews. 2002, s. 250–271. doi:10.1128/MMBR.66.2.250-271.2002. PMID 12040126.
- ↑ a b William R. Cullen; Kenneth J. Reimer. Arsenic speciation in the environment. Chemical Reviews. 1989, s. 713–764. doi:10.1021/cr00094a002.
- ↑ Kevin A. Francesconi; John S. Edmonds. Arsenic Species in Marine Samples. Croatica Chemica Acta. 1998, s. 343–359. Dostupné v archivu pořízeném z originálu dne 2008-03-09.
- ↑ John S. Edmonds; Kevin A. Francesconi; Jack R. Cannon; Colin L. Raston; Brian W. Skelton; Allan H. White. Isolation, crystal structure and synthesis of arsenobetaine, the arsenical constituent of the western rock lobster panulirus longipes cygnus. Tetrahedron Letters. 1977, s. 1543–1546. doi:10.1016/S0040-4039(01)93098-9.
- ↑ Alice Rumpler; John S. Edmonds; Mariko Katsu; Kenneth B. Jensen; Walter Goessler; Georg Raber; Helga Gunnlaugsdottir. Arsenic-Containing Long-Chain Fatty Acids in Cod-Liver Oil: A Result of Biosynthetic Infidelity?. Angewandte Chemie International Edition. 2008, s. 2665–2667. doi:10.1002/anie.200705405. PMID 18306198.
- ↑ a b Ines Mancini; Graziano Guella; Maryvonne Frostin; Edouard Hnawia; Dominique Laurent; Cecile Debitus; Francesco Pietra. On the First Polyarsenic Organic Compound from Nature: Arsenicin a from the New Caledonian Marine SpongeEchinochalina bargibanti. Chemistry: A European Journal. 2006, s. 8989–8994. doi:10.1002/chem.200600783. PMID 17039560.
- ↑ http://www.sigmaaldrich.com
- ↑ Revision of the Extended Hantzsch-Widman System of Nomenclature for Heteromonocycles
- ↑ Nicholas C. Norman. Chemistry of arsenic, antimony, and bismuth. [s.l.]: Springer, 1998. ISBN 978-0-7514-0389-3. S. 235.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Organické sloučeniny arsenu na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organické sloučeniny arsenu na Wikimedia Commons
