Chlorid chromitý
| Chlorid chromitý | |
|---|---|
 Bezvodý | |
 Hexahydrát | |
| Obecné | |
| Systematický název | Chlorid chromitý |
| Anglický název | Chromium(III) chloride |
| Německý název | Chrom(III)-chlorid |
| Sumární vzorec | CrCl3 |
| Vzhled | fialový prášek temně zelené, zelené nebo fialové krystaly (hexahydrát) |
| Identifikace | |
| Registrační číslo CAS | 10025-73-7 10060-12-5 (hexahydrát) |
| PubChem | 6452300 |
| ChEBI | 53351 |
| Číslo RTECS | GB5425000 |
| Vlastnosti | |
| Molární hmotnost | 158,355 g/mol 266,48 g/mol (hexahydrát) |
| Teplota tání | 1 150 °C (tlak) 83 °C (hexahydrát) |
| Teplota sublimace | 950 °C |
| Teplota rozkladu | 1 300 °C |
| Hustota | 2,915 6 g/cm3 1,760 g/cm3 (hexahydrát) |
| Rozpustnost ve vodě | velmi málo |
| Rozpustnost v polárních rozpouštědlech | methanol diethylether aceton |
| Měrná magnetická susceptibilita | 546,64×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | klencová nebo šesterečná |
| Hrana krystalové mřížky | a = 595,3 pm c = 1 744 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −563,3 kJ/mol |
| Standardní molární entropie S° | 125,6 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −493,8 kJ/mol |
| Izobarické měrné teplo cp | 0,580 JK−1g−1 |
| Bezpečnost | |
| R-věty | R22 |
| S-věty | S24/25 |
| NFPA 704 |  0
3
0
|
Některá data mohou pocházet z datové položky. | |
Chlorid chromitý (chemický vzorec CrCl3) tvoří v bezvodém stavu červenofialové (broskvové) lesklé lístečky, které lze při červeném žáru v proudu chloru přečišťovat sublimací. Bez přítomnosti chlóru dochází k částečnému rozkladu na chlorid chromnatý CrCl2 a chlór. Ve vodě a ethanolu se rozpouští velice omezeně, a to i za varu. Rozpouští se ovšem, pokud je v kapalině přítomno aspoň malé množství chloridu chromnatého CrCl2, a to dokonce za uvolňování tepla (vzniká tmavozelený roztok hexahydrátu). Rozpustnější je dále i bez přidání CrCl2 v methanolu, diethyletheru a acetonu. Má nasládlou chuť. Hydráty mají složitější komplexní povahu a jejich struktura je podrobněji popsána níže.
Hydráty chloridu chromitého
[editovat | editovat zdroj]Z vodného roztoku krystaluje tmavozelený hexahydrát CrCl3 • 6 H2O, který má oktaedrické ligandové pole kolem centrálního atomu Cr3+. Srážecí reakcí s dusičnanem stříbrným AgNO3 se ovšem podle stechiometrické reakce srazí pouze jeden z přítomných chloridových aniontů, což znamená, že zbývající 2 musí být ve sloučenině vázány komplexně. Strukturně správný zápis vzorce vystihuje proto tvar [Cr(H2O)4Cl2]Cl • 2 H2O, systematicky se tato sloučenina potom nazývá dihydrát chloridu tetraaqua-dichloridochromitého. Kromě této sloučeniny, kterou lze považovat za hexahydrát chloridu chromitého, existují ovšem i její další dva hydrátové izomery.
Existuje dále zelená sloučenina se vzorcem [Cr(H2O)5Cl]Cl2 • H2O (hydrát dichloridu pentaaqua-chloridochromitého) a šedomodrý [Cr(H2O)6]Cl3 (trichlorid hexaaquachromitý). Rozlišení těchto sloučenin od sebe se provádí již výše zmíněným srážením s dusičnanem stříbrným AgNO3 a podle množství sraženého chloridu stříbrného AgCl lze ze stechiometrické rovnice jednoduše vypočítat, o který z těchto hydrátů se jedná:
- [Cr(H2O)4Cl2]Cl + 3 AgNO3 → [Cr(H2O)4Cl2]NO3 + 2 AgNO3 + AgCl↓
- [Cr(H2O)5Cl]Cl2 + 3 AgNO3 → [Cr(H2O)5Cl](NO3)2 + AgNO3 + 2 AgCl↓
- [Cr(H2O)6]Cl3 + 3 AgNO3 → [Cr(H2O)6](NO3)3 + 3 AgCl↓
Pokud se nechá chlorid chromitý krystalovat z roztoků ochlazovaných pod 6 °C, tak z nich krystaluje v podobě dekahydrátu CrCl3 • 10 H2O.
Příprava
[editovat | editovat zdroj]Bezvodý chlorid chromitý lze připravit vedením suchého chlóru přes kovový chrom zahřátý do červeného žáru. Jedná se sice o exotermickou reakci, ta ovšem neprodukuje tolik tepla, aby se následně sama udržela v chodu:
- 2 Cr + 3 Cl2 → 2 CrCl3
Dalším způsobem přípravy je vedení suchého chlóru přes směs oxidu chromitého Cr2O3 a uhlí zahřátou k žáru:
- Cr2O3 + 3 C + 3 Cl2 → 2 CrCl3 + 3 CO
Další možností je zahřívání oxidu chromitého Cr2O3 s chloridem uhličitým CCl4 nebo chloridem sirným S2Cl2:
- Cr2O3 + 3 CCl4 → 2 CrCl3 + 3 COCl2
- 2 Cr2O3 + 6 S2Cl2 + 9 O2 → 4 CrCl3 + 12 SO2
Reakce a použití
[editovat | editovat zdroj]Bezvodý chlorid chromitý reaguje s jinými sloučeninami za vzniku dalších chromitých sloučenin. Žíháním na vzduchu přechází v zelený oxid chromitý. Působením sulfanu H2S, amoniaku NH3 nebo fosfanu PH3 za žáru ho lze převést na sloučeniny s příslušným aniontem.
- 4 CrCl3 + 3 O2 → 2Cr2O3 + 6 Cl2
- 2 CrCl3 + 3 H2S → Cr2S3 + 6 HCl
- CrCl3 + NH3 → CrN + 3 HCl
- CrCl3 + PH3 → CrP + 3 HCl
Chlorid chromitý je Lewisova kyselina, která patří mezi tzv. tvrdé kyseliny a tvoří velmi často sloučeniny typu [CrCl3L3], kde L je Lewisova báze. Například reakcí s pyridinem C5H5N vzniká adukt:
- CrCl3 + 3 C5H5N → [CrCl3(C5H5N)3]
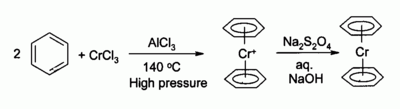
S roztavenými chloridy alkalických kovů, jako například chloridem draselným KCl, dává chlorid chromitý oktaedrické komplexy typu K3[CrCl6] nebo při větším množství CrCl3 K3[Cr2Cl9] , který je rovněž oktaedrický, ale ve kterém jsou 2 atomy chromu spojeny přes 3 atomy chloru můstkovou vazbou. Chlorid chromitý se používá jako prekurzor pro velké množství sloučenin, například bis(benzen)chrom, analog ferrocenu:
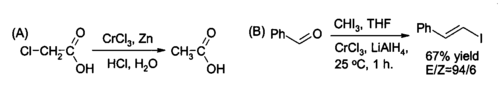
Mezi způsoby využití chloridu chromitého v organické syntéze patří jeho redukce na chlorid chromnatý CrCl2 přímo v reakční směsi a použití jako činidlo na (A) redukci alkylhalogenidů a (B) syntéza (trans)-alkenylhalogenidů. Reakce se obvykle provádí pomocí dvou molů CrCl3 na mol tetrahydridohlinitanu lithného Li[AlH4], i když v případě vodného roztoku stačí zinek a kyselina chlorovodíková.
Chlorid chromitý se jako Lewisova kyselina rovněž využívá ke katalýze nitroso Dielsových–Alderových reakcí.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Chromium(III) chloride na anglické Wikipedii.
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
- Dr. Heinrich Remy, Anorganická chemie 2. díl, 1. vydání 1961
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu chlorid chromitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid chromitý na Wikimedia Commons


![[Cr(H2O)6]Cl3](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/-Cr%28H2O%296-Cl3.JPG/250px--Cr%28H2O%296-Cl3.JPG)
![[Cr(H2O)5Cl]Cl2.H2O](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b7/-Cr%28H2O%295Cl-Cl2.H2O.jpg/250px--Cr%28H2O%295Cl-Cl2.H2O.jpg)
![[Cr(H2O)4Cl2]Cl.2H2O](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a4/-Cr%28H2O%294Cl2-Cl.2H2O.jpg/250px--Cr%28H2O%294Cl2-Cl.2H2O.jpg)