Chlorid sirný
| Chlorid sirný | |
|---|---|
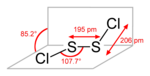 strukturní vzorec | |
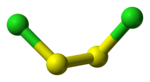 kuličkový model molekuly | |
 kalotový model molekuly | |
| Obecné | |
| Systematický název | dichlordisulfan |
| Anglický název | disulfur dichloride |
| Německý název | Dischwefeldichlorid |
| Sumární vzorec | S2Cl2 |
| Vzhled | světle jantarová až žlutooranžová olejovitá kapalina |
| Identifikace | |
| Registrační číslo CAS | 10025-67-9 |
| SMILES | ClSSCl |
| InChI | InChI=1S/Cl2S2/c1-3-4-2 |
| Vlastnosti | |
| Molární hmotnost | 135,04 g/mol |
| Teplota tání | −80 °C (193 K) |
| Teplota varu | 137,11 °C (410,2 K) |
| Hustota | 1,688 g/cm3 |
| Index lomu | 1,658 |
| Rozpustnost ve vodě | rozklad za uvolnění HCl |
| Měrná magnetická susceptibilita | −4,61×105 μm3/g |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R14 R20 R25 R29 R35 R50 |
| S-věty | S1/2 S26 S36/37/39 S45 S61 |
| Teplota vzplanutí | 118,5 °C |
| Teplota vznícení | 234 °C |
Některá data mohou pocházet z datové položky. | |
Chlorid sirný je anorganická sloučenina se vzorcem S2Cl2, jeden z chloridů síry. Jeho základní strukturní vzorec je Cl-S-S-Cl, úhel mezi rovinami vazeb Cl-S-S- je 90°. Tvar molekuly je podobný jako u H2O2. Dalším izomerem je S=SCl2, který se přechodně vytváří při vystavení S2Cl2 ultrafialovému záření.
Příprava a vlastnosti
[editovat | editovat zdroj]Čistý chlorid sirný je žlutá kapalina, která na vzduchu tvoří dým díky reakci s vodou:
- 16 S2Cl2 + 16 H2O → 8 SO2 + 32 HCl + 3 S8
Vyrábí se částečnou chlorací elementární síry, reakce probíhá za pokojové teploty. V laboratoři se plynný chlor vede do baňky obsahující elementární síru, jakmile vznikne S2Cl2, obsah se změní na žlutou kapalinu:[2][3]
- S8 + 4 Cl2 → 4 S2Cl2 ΔH = −58,2 kJ/mol
Další přídavek chloru vytvoří chlorid sirnatý, který způsobí zabarvení do oranžovočervena:[3]
- S2Cl2 + Cl2 ↔ 2 SCl2 ΔH = −40,6 kJ/mol
Reakce je vratná a SCl2 postupně uvolňuje chlor za opětovného vzniku S2Cl2. Chlorid sirný může rozpustit velké množství síry za tvorby dichlorpolysulfanů:
- S2Cl2 + n S → S2+nCl2
Čistý chlorid sirný se získává destilací žlutooranžové kapaliny (směsi S2Cl2 a SCl2) nebo přidáním síry.
S2Cl2 také vzniká chlorací sirouhlíku při výrobě thiofosgenu.
Reakce
[editovat | editovat zdroj]Chlorid sirný se hydrolyzuje na oxid siřičitý a elementární síru. Reakcí se sulfanem vznikají polysulfany, například:
- 2 H2S + S2Cl2 → H2S4 + 2 HCl
S2Cl2 reaguje s amoniakem za vzniku imidu heptasíry (S7NH) a podobných cyklických sloučenin S8−x(NH)x (x = 2, 3).
Použití
[editovat | editovat zdroj]Chlorid sirný se používá k tvorbě vazeb C-S. Za přítomnosti AlCl3 reaguje s benzenem za vzniku difenylsulfidu:
- 8 S2Cl2 + 16 C6H6 → 8 (C6H5)2S + 16 HCl + S8
Aniliny reagují s S2Cl2 za přítomnosti NaOH Herzovou reakcí, přičemž vznikají ortho-aminothiofenoláty, tyto látky jsou prekurzory thioindigových barviv. S2Cl2 se také využívá na výrobu yperitu reakcí s ethylenem při 60 °C:
- 8 S2Cl2 + 16 C2H4 → 8 (ClC2H4)2S + S8
Další použití zahrnují výrobu sirných barviv, insekticidů a syntetických kaučuků. Tato látka se také používá na studenou vulkanizaci kaučuku, jako katalyzátor polymerace rostlinných olejů a na zvyšování tvrdosti dřeva.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Disulfur dichloride na anglické Wikipedii.
- ↑ a b Sulfur monochloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ F. Fehér "Dichlorodisulfane" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 371.
- ↑ a b GREENWOOD, Norman Neill; EARNSHAW, Alan. Chemie prvků. Sv. 2.. 1. vyd. vyd. Praha: Informatorium 13 s. S.794-1635 s. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. S. 847-848.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu chlorid sirný na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid sirný na Wikimedia Commons




