Synton
Synton je hypotetická jednotka odpovídající potenciálnímu činidlu při retrosyntéze. Toto označení zavedl Elias James Corey v roce 1967.[1]
Příklad
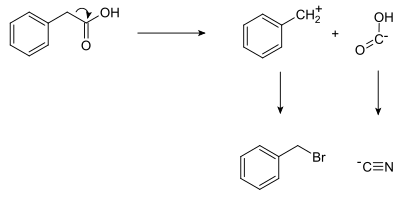
[editovat | editovat zdroj]Při retrosyntéze kyseliny fenyloctové se objevují dva syntony: nukleofilní skupina „COOH−“ a elektrofilní skupina PhCH -
2 . Tyto skupiny se nevyskytují samy o sobě a k reakci vytvářející požadovaný produkt se použijí jejich syntetické ekvivalenty; v tomto případě kyanidový anion jako syntetický ekvivalent COOH− a benzylbromid jako ekvivalent benzylového syntonu. Příprava kyseliny fenyloctové na základě retrosyntézy tak vypadá takto:
- Ph-CH2-Br + Na+C≡N− → Ph-CH2-C≡N + NaBr
- Ph-CH2-C≡N + 2 H2O → Ph-CH2-C(=O)-OH + NH3
(Ph = fenyl).
- C2 syntony – acetylen, acetaldehyd
- -C2H4OH synton – ethylenoxid
- karbokationtové syntony – alkylhalogenidy
- karboaniontové syntony – Grignardova činidla, organolithné sloučeniny, substituované acetylidy
Použití označení u syntetických oligonukleotidů
[editovat | editovat zdroj]Označení synton se používá i při syntézách genů.[2]
Karbokationtové syntony
[editovat | editovat zdroj]
Příkladem syntézy využívající rozpojení cyklické molekuly a tvorbu karbokationtových syntonů je Pictetova–Spenglerova reakce; dochází při ní k reakci pí vazby C-C a iminiového iontu, obvykle získaného kondenzací aminu s aldehydem. Pictetova–Spenglerova reakce byla využita na přípravu řady indolů a isochinolinů.[3]
K tvorbě nových vazeb uhlík-uhlík se často používají karboaniontové alkylace. Jako alkylační činidla slouží alkylhalogenidy nebo podobné sloučeniny s dobrými odstupujícími skupinami. Obzvláště vhodné pro SN2 reakce jsou allylhalogenidy. Celestolid (4-acetyl-6-terc-butyl-1,1-dimethylindan, jednu ze slžek pižma) lze vytvořit s využitím alkylace benzylového aniontu 3-chlor-2-methylprop-1-enu jako jednoho z kroků.[4]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Synthon na anglické Wikipedii.
- ↑ E. J. Corey. General methods for the construction of complex molecules. Pure and Applied Chemistry. 1967, s. 30–37. Dostupné online. DOI 10.1351/pac196714010019.
- ↑ Sarah J. Kodumal; Kedar G. Patel; Ralph Reid; Hugo G. Menzella; Mark Welch; Daniel V. Santi. Total synthesis of long DNA sequences: Synthesis of a contiguous 32-kb polyketide synthase gene cluster. Proceedings of the National Academy of Sciences of the United States of America. 2004-11-02, s. 15573–15578. DOI 10.1073/pnas.0406911101. PMID 15496466. Bibcode 2004PNAS..10115573K.
- ↑ W. M. Whaley; T. R. Govindachari. The Pictet-Spengler Synthesis of Tetrahydroisoquinolines and Related Compounds. Organic Reactions. 1951, s. 151. ISBN 0471264180. DOI 10.1002/0471264180.or006.03.
- ↑ Shinzo Kagabu; Yuka Kojima. A synthesis of indane musk Celestolide. Journal of Chemical Education. 1992, s. 420. DOI 10.1021/ed069p420. Bibcode 1992JChEd..69..420K.