Karboxylátové komplexy přechodných kovů

Karboxylátové komplexy přechodných kovů jsou komplexy obsahující karboxylátové (RCOO−) ligandy. Některé mají praktické využití, jiné jsou především předměty akademického zájmu. Kovy se na karboxylátové ligandy mohou vázat mnoha různými způsoby, nejčastější jsou κ1- (O-monodentátní), κ2 (O,O-bidentátní), a můstky.
Monokarboxyláty
[editovat | editovat zdroj]Struktura
[editovat | editovat zdroj]Karboxyláty se na jednotlivé kovy mohou vázat jedním (κ1) nebo oběma atomy kyslíku (κ2). Karboxyláty typu κ1 jsou ligandy typu X, podobají se tedy pseudohalogenidům. Bidentátní karboxyláty (κ2) jsou ligandy typu L-X, připomínají spojení Lewisovy zásady (L) a pseudohalogenidu (X). Podle teorie HSAB jsou karboxyláty tvrdými ligandy.
- Struktury
-
Zásaditý octan železitý
-
Zásaditý octan zinečnatý
-
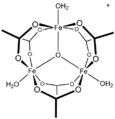
[CoO(ac)]4, Dasův kuban
Jako vzor jednoduchých karboxylátových komplexů lze použít octany; většina octanů přechodných kovů obsahuje více různých ligandů, příkladem může být tetrahydrát octanu nikelnatého, Ni(O2CCH3)2(H2O)4, který má vnitromolekulární vodíkové vazby mezi protony aqua ligandů a nekoordinovanými kyslíky. K těmto komplexům patří také zásadité octany, [M3O(OAc)6(H2O)3]n+.[2]

Homoleptické komplexy
[editovat | editovat zdroj]Homoleptické karboxylátové komplexy jsou obvykle, ale ne vždy, koordinačními polymery.
K molekulovým monokarboxylátům patří mimo jiné octan stříbrný, Ag2(OAc)2.
- Molekulové diacetáty se vyskytují častěji, příklady mohou být tetraoctany dikovů, jako octan rhodnatý, octan měďnatý, octan molybdenatý, a octan chromnatý. Octan platnatý a octan palladnatý obsahují jádra o složení Pt4/Pd3, což je následek toho, že octanové ligandy stabilizují struktury s více atomy kovů.
- Jednojadernými trikarboxyláty jsou například deriváty kyseliny adamantan-1-karboxylové, odpovídající vzorci [M(O2CC10H11)4]− (M = Co, Ni, Zn).[4]
Reakce a použití
[editovat | editovat zdroj]Pokusy o přípravu některých karboxylátových komplexů vedly, zejména u silně elektrofilních kovů, k oxosloučeninám. Vznikaly tak například oxoacetáty Fe3+, Mn3+, a Cr3+.
Karboxyláty kovů, nejčastěji ethylhexanoáty[5] Katalyzují zpravidla oxidační reakce.
Příprava a výroba
[editovat | editovat zdroj]Karboxylátové komplexy se dají připravit mnoha způsoby. Při použití již vytvořených karboxylových kyselin jde o:[6]
- neutralizace: LnMOR' + RCOOH → LnMOOCR + R'OH
- protonolýza: LnMalkyl + RCOOH → LnMOOCR + alkan
- oxidační adice: LnM + RCOOH → Ln(H)MOOCR
Také lze, pomocí podvojné záměny, přeměnit jeden karboxylát v jiný:
- LnMCl + RCOONa → LnMOOCR + NaCl
Karoxyláty je možné vytvořit rovněž karbonacemi alkylů kovů (které jsou velmi silnými zásadami):
- LnMR + CO2 → LnMOOCR
Reakce
[editovat | editovat zdroj]
Častými reakcemi karboxylátů jsou jejich nahrazování zásaditějšími ligandy. Obzvláště náchylné jsou k protonolýzám, které se tak často používají k nahrazování karboxylových kyselin; takto lze například připravit oktachlorodimolybdenatan draselný z octanu molybdenatého:
- Mo2(OOCCH3)4 + 8 HCl → [Mo2Cl8]2− + 4 CH3COOH
Octany elektrofilních kovů lze použít jako zásady při soustředěných metalacích-deprotonacích.[7]
Pyrolýzou karboxylátu vzniká acylanhydrid a oxid kovu. Touto reakcí vzniká například zásaditý octan zinečnatý z bezvodé soli.
Některé monodentátní karboxyláty je možné O-alkylovat silnými alkylačními činidly za vzniku esterů.
Di- a polykarboxyláty
[editovat | editovat zdroj]Benzendi- a trikarboxyláty
[editovat | editovat zdroj]Kovoorganické kostry, pórovité trojrozměrné koordinační polymery, se často připravují z karboxylátů. Shluky karboxylátů bývají propojeny konjugovanými zásadami benzendikarboxylových a benzentrikarboxylových kyselin.[8]
Aminopolykarboxyláty
[editovat | editovat zdroj]-
Komplex kovu s aniontem kyseliny ethylendiamintetraoctové
-
Bis(iminodiacetát) železitý
-
Aktivní místo hemerythrinu, železnatého karboxylátu sloužícího jako přenašeč kyslíku
Významnou skupinou karboxylátů jsou aminopolykarboxyláty, odvozené od polykarboxylových aminokyselin, jako například EDTA4−; podobnou skupinou jsou aminokyselinové komplexy. Dvě aminokyseliny, kyselina glutamová a kyselina asparagová, mají karboxylátové postranní řetězce, které mohou sloužit jako ligandy pro železo v nehemových Fe-proteinech, jako například hemerythrinu.[9]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Transition metal carboxylate complex na anglické Wikipedii.
- ↑ Alicia B. Brignole; F. A. Cotton. Rhenium and Molybdenum Compounds Containing Quadruple Bonds. Inorganic Syntheses. 1972, s. 81–89. doi:10.1002/9780470132449.ch15.
- ↑ Janet Catterick; Peter Thornton. Structures and Physical Properties of Polynuclear Carboxylates. Advances in Inorganic Chemistry and Radiochemistry. 1977, s. 291–362. ISBN 9780120236206. doi:10.1016/S0065-2792(08)60041-2.
- ↑ Gao Zhang; Jian Lin; Dong-Wei Guo; Shi-Yan Yao; Yun-Qi Tian. Infinite Coordination Polymers of One- and Two-dimensional Cobalt Acetates. Zeitschrift für Anorganische und Allgemeine Chemie. 2010, s. 1401–1404. doi:10.1002/zaac.200900457.
- ↑ E. Yu. Fursova; G. V. Romanenko; S. E. Tolstikov; V. I. Ovcharenko. Mononuclear Transition Metal Adamantane-1-Carboxylates. Russian Chemical Bulletin. 2019, s. 1669–1674. doi:10.1007/s11172-019-2610-4.
- ↑ Angelo Nora; Alfred Szczepanek; Gunther Koenen. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.]: [s.n.], 2001. ISBN 3527306730. doi:10.1002/14356007.a16_361. Kapitola Metallic Soaps.
- ↑ Raúl García-Rodríguez; Mark P. Hendricks; Brandi M. Cossairt; Haitao Liu; Jonathan S. Owen. Conversion Reactions of Cadmium Chalcogenide Nanocrystal Precursors. Chemistry of Materials. 2013, s. 1233–1249. doi:10.1021/cm3035642.
- ↑ Lutz Ackermann. Carboxylate-Assisted Transition-Metal-Catalyzed C−H Bond Functionalizations: Mechanism and Scope. Chemical Reviews. 2011-03-09, s. 1315–1345. Dostupné online. ISSN 0009-2665. doi:10.1021/cr100412j. PMID 21391562.
- ↑ David J. Tranchemontagne; José L. Mendoza-Cortés; Michael O'Keeffe; Omar M. Yaghi. Secondary Building Units, Nets and Bonding in the Chemistry of Metal–Organic Frameworks. Chemical Society Reviews. 2009, s. 1257. Dostupné online. doi:10.1039/b817735j. PMID 19384437. Archivováno 14. 9. 2020 na Wayback Machine.
- ↑ Andrew J. Jasniewski; Lawrence Que. Dioxygen Activation by Nonheme Diiron Enzymes: Diverse Dioxygen Adducts, High-Valent Intermediates, and Related Model Complexes. Chemical Reviews. 2018, s. 2554–2592. doi:10.1021/acs.chemrev.7b00457. PMID 29400961.



![[CoO(ac)]4, Dasův kuban](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/DasCubane.svg/120px-DasCubane.svg.png)


