Aminokyselinové komplexy kovů
Aminokyselinové komplexy kovů jsou skupina komplexních sloučenin, které obsahují konjugované zásady aminokyselin, aminokarboxyláty. Aminokyseliny jsou v přírodě široce rozšířené a všechny mohou sloužit jako ligandy pro přechodné kovy.[1]
Tento článek nepopisuje komplexy amidů (jako jsou například peptidy) a esterů aminokyselin. Rovněž di něj nejsou zahrnuty polyaminokyseliny, kam patří mimo jiné kyselina ethylendiamintetraoctová a nitrilotrioctová.
Druhy vazeb
[editovat | editovat zdroj]
Nejčastěji se aminokyseliny na kovy navazují jako bidentátní N,O ligandy, kdy využívají aminovou i karboxylovou skupinu; v takových případech se vytváří pětičlenné chelatační kruhy. Chelátový kruh je na sp3-hybridizovaném uhlíku a na dusících mírně odchýlen od pravidelného tvaru.
U aminokyselin obsahujících koordinující substituenty je rozsah možných struktur širší, protože se do koordinace mohou zapojit také tyto substituenty. Histidin, kyselina asparagová, methionin, a cystein občas tvoří tridentátní komplexy typů N,N,O, N,O,O, S,N,O, a S,N,O.
Jsou známy i komplexy kineticky inertních iontů kovů s monodentátními aminokyselinovými ligandy, mohou být vázané přes dusík i přes kyslík. Předpokládá se přechodná existence takových komplexů u řady kineticky nestálých kovových iontů, jako je Zn2+.
Stechiometrie a struktura
[editovat | editovat zdroj]Homoleptické komplexy (pouze aminokyselinové ligandy)
[editovat | editovat zdroj]Smícháním solí kovů s roztoky aminokyselin za neutrálního nebo zásaditého pH obvykle vznikají bis- či tris-komplexy. U kovových iontů upřednostňujících oktaedrické uspořádání mívají stechiometrii M(aa)3 (aa = aminokarboxylát, například glycinát, H2NCH2COO−.
Komplexy se stechiometrií 3:1 odpovídají vzorci [M(O2CC(R)HNH2)3]z a jsou oktaedrické. Mohou vytvářet faciální a meridionální izomery, oba chirální. Počet možných stereoizomerů je vyšší u aminokyselin, které nejsou homochirální. U tris(glycinátu) kobaltitého byl izolován fialový meridionální i červeno-růžový faciální izomer.[6]
Komplexy L-alaninu, L-leucinu, a dalších aminokyselin mají čtyři stereoizomery.[7]
Cystein se váže skrz atom N a thiolátovou skupinu.[8]
Ke komplexům se stechiometrií 2:1 patří například glycinát měďnatý, [Cu(O2CC(R)HNH2)2], který je znám v bezvodé podobě i jako pentahydrát. Pokud je geometrie čtvercově rovinná, tak komplexy tohoto druhu vytváří cis- a trans-izomery. I zde se různorodost stereochemie zvyšuje u komplexů aminokyselin, které nejsou homochirální.
Jsou známy i homoleptické komplexy tridentátních aminokyselin, jako je Ni(κ3-histidinát)2.
Peptidy a bílkoviny
[editovat | editovat zdroj]Mimo samotné aminokyseliny mohou i peptidy a bílkoviny tvořit komplexy s kovy, které slouží jako kofaktory. Alfa-aminové a karboxylátové skupiny aminokyselin se většinou tvorby komplexů neúčastní, protož jsou zapojeny do peptidových vazeb. U zbytků na N-koncích jsou dostupné α-aminové a na O-koncích karboxylátové skupiny. Významnými aminokyselinami pro takové případy jsou histidin (imidazol), cystein (thiolát), a methionin (thioether).
Heteroleptické komplexy (aminokyseliny a další ligandy)
[editovat | editovat zdroj]
Komplexy s ligandy více druhů jsou běžné u mnoha aminokyselin. Příkladem může být [Co(en)2(glycinát)]2+, obsahující en (ethylendiamin). Z organokovových komplexů jde například o Cp*Ir(κ3-methionin).
Příprava a reakce
[editovat | editovat zdroj]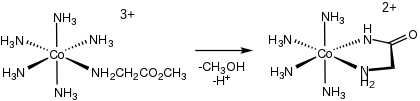
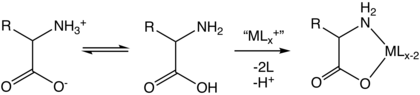
Jako příklad tvorby aminokyselinového komplexu lze uvést glycinát kobaltitý, připravovaný reakcí glycinu s triskarbonátokobaltitanem sodným.[6] Podobně se připravují také tris(cheláty) dalších aminokyselin.[7]
Dalším způsobem je výměna ligandů aquakomplexů a konjugovaných zásad aminokyselin:[10]
- [PtCl4]2− + 2 H2NCH(R)CO2− → [Pt(H2NCH(R)CO2)2] + 4 Cl−
V bioanorganické chemii se používá příprava hydrolýzou amidů a esterů aminokyselin (en = ethylendiamin):
- [(en)2CoOH(κ1N-H2NCH(R)CO2Et)]2+ → [(en)2CoOH(κ2NO-H2NCH(R)CO2)]2+ + EtOH
Protože jsou příslušné pětičlenné chelatační kruhy MNC2O poměrně stálé, tak se aminokyselinové komplexy používají jako chránicí skupiny pro aminokyseliny, což rozšiřuje rozsah možných reakcí na postranním řetězci.[11]
Aminokarboxylátové komplexy
[editovat | editovat zdroj]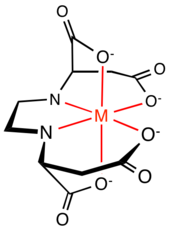
Organické sloučeniny obsahující dvě nebo více 2- a 3-aminokarboxylátových skupin se často objevují v přírodě, průmyslu i výzkumu. Patří sem například kyselina ethylendiamintetraoctová a kyselina nitrilotrioctová.
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Transition metal amino acid complexes na anglické Wikipedii.
- ↑ K. Severin; R. Bergs; W. Beck. Bioorganometallic Chemistry-Transition Metal Complexes with α-Amino Acids and Peptides. Angewandte Chemie International Edition. 1998, s. 1635–1654. DOI 10.1002/(SICI)1521-3773(19980703)37:12<1634::AID-ANIE1634>3.0.CO;2-C. PMID 29711516.
- ↑ K.-Q. Gu; Y.-X. Sun; R. Zhang; N.-W. Zhang; H.-W. Che. Tris(glycinato-κ2N,O)cobalt(III). Acta Crystallographica. 2007, s. m740–m742. DOI 10.1107/S1600536807005636.
- ↑ A. Abbasi; B. Safarkoopayeh; N. Khosravi; A. Shayesteh. Structural Studies of Bis(histidinato)nickel(II): Combined Experimental and Computational Studies. Comptes Rendus Chimie. 2017, s. 467. Dostupné online. DOI 10.1016/j.crci.2016.12.006.
- ↑ M. Scharwitz; T. van Almsick; W. S. Sheldrick. (S-Methylcysteinato)(η5-pentamethylcyclopentadienyl)iridium(III) Trifluoromethanesulfonate hemihydrate. Acta Crystallographica. 2007, s. m230–m232. DOI 10.1107/S1600536806053360.
- ↑ N. Baidya; D. Ndreu; M. M. Olmstead; P. K. Mascharak. Synthesis, Structure, and Properties of Potassium bis(L-cysteinato-N,S)nickelate(II) sesquihydrate. Inorganic Chemistry. 1991, s. 2448–2451. DOI 10.1021/ic00010a043.
- ↑ a b George B. Kauffman; Mohammad Karbassi; Eishin Kyuno. Tris(glycinato)cobalt(III). Inorganic Syntheses. 1989, s. 135–139. ISBN 978-0-470-13256-2. DOI 10.1002/9780470132562.ch32.
- ↑ a b R. G. Denning; T. S. Piper. Optical Activity, Absolute Configuration, and Rearrangement Reactions of Tris Amino Acid Complexes of Cobalt(III) with L-Alanine, L-Leucine, and L-Proline. Inorganic Chemistry. 1966, s. 1056–1065. DOI 10.1021/ic50040a022.
- ↑ Alan P. Arnold; W. Gregory Jackson. Stereospecificity in the Synthesis of the Tris((R)-Cysteinato-N,S)- and Tris((R)-Cysteinesulfinato-N,S)cobaltate(III) Ions. Inorganic Chemistry. 1990, s. 3618–3620. DOI 10.1021/ic00343a061.
- ↑ R. Motterlini; L. E. Otterbein. The therapeutic potential of carbon monoxide. Nature Reviews Drug Discovery. 2010, s. 728–743. DOI 10.1038/nrd3228. PMID 20811383.
- ↑ A. Iakovidis; N. Hadjiliadis. Complex Compounds of Platinum(II) and (IV) with Amino Acids, Peptides and Their Derivatives. Coordination Chemistry Reviews. 1994, s. 17–63. DOI 10.1016/0010-8545(94)80064-2.
- ↑ Wolfgang Beck. Metal Ions and Metal Complexes as Protective Groups of Amino Acids and Peptides – Reactions at Coordinated Amino Acids. Zeitschrift für Naturforschung. 2009, s. 1221–1245. DOI 10.1515/znb-2009-11-1202.

![Co(glycinát)3[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ed/SEZMEQ.png/120px-SEZMEQ.png)
![[Ni(κ3-histidinát)2]2−[3]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9b/RAGZAD.png/95px-RAGZAD.png)
![Cp*]]Ir(κ3-methionin)]+[4]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/41/GEVLID.png/112px-GEVLID.png)
![[Ni(cysteinát)2]2−[5]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/47/KIWZOF.png/120px-KIWZOF.png)