Buchnerovo rozšiřování kruhů
Buchnerovo rozšiřování kruhů je dvoukroková organická reakce používaná na přípravu sedmičlenných kruhů. Prvním krokem je tvorba karbenu z ethyldiazoacetátu, který se poté cyklopropanací přemění na aromatický kruh. Samotné rozšiřování kruhu nastává ve druhém kroku, kde elektrocyklická reakce otevírá kruh cyklopropanu.

Historie
[editovat | editovat zdroj]Tuto reakci objevili v roce 1885 Eduard Buchner a Theodor Curtius,[1][2] kteří připravili karben z ethyldiazoacetátu a jeho tepelnými i fotochemickými reakcemi s benzenem vytvářeli deriváty cykloheptatrienu. Produktem byla směs čytř navzájem izomerních karboxylových kyselin.
Pokroky v organokovové chemii umožnily zlepšit selektivitu těchto reakcí. V 80. letech 20. století bylo zjištěno, že dirhodiové katalyzátory poskytují jediné izomery, a to s vysokými výtěžnostmi.[3]
Příprava ethyldiazoacetátu
[editovat | editovat zdroj]Buchnerova první syntéza cykloheptatrienů, provedená v roce 1885, využívala k tvorbě karbenů fotolytické a tepelné reakce. Ethyldiazoacetát se připravuje reakcí ethylesteru glycinu s dusitanem sodným a octanem sodným ve vodném roztoku.[4]
Příprava karbenoidu
[editovat | editovat zdroj]V 60. letech byla vyvinuta příprava karbenoidů stereoselektivními cyklopropanacemi pomocí katalyzátorů založených na mědi,[5] v 80. letech se objevily dirhodiové katalyzátory. Pokroky v organokovové chemii umožnily zlepšit selektivitu tvorby cyklohexatrienů obměňováním ligandů navázaných na katalyzátor.[6]
Mechanismus
[editovat | editovat zdroj]První krok
[editovat | editovat zdroj]Mechanismus Buchnerova rozšiřování kruhů začíná vytvořením karbenu z ethyldiazoacetátu fotochemickou nebo tepelně spouštěnou reakcí; přitom se oddělí dusík.
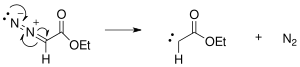
Tento karben se naváže na benzen a vytvoří cyklopropanový kruh.
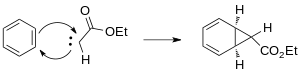
První krok lze také katalyzovat přechodnými kovy, hlavně Cu, Rh a Ru, s řadou různých ligandů.[5] Rhodnaté katalyzátory snižují počet vzniklých produktů, jelikož vytvářejí převážně kinetické cykloheptatrienylové estery.[6] Elektrofilita karbenů vzniklých při katalýze rhodiem vede k převaze reakcí na nukleofilnějších vazbách π aromatických kruhů.[7]
Všeobecně přijímaný katalytický cyklus tvorby karbenů byl navržen v roce 1952.[8][9] V tomto cyklu se nejprve diazosloučenina oxidačně aduje na komplex kov-ligand. Posléze se oddělí dusík a vzniká karben, který reaguje s aromatickou sloučeninou bohatou na elektrony, čímž se redukcí obnovuje katalyzátor.

Druhý krok
[editovat | editovat zdroj]Druhý krok Buchnerovy reakce spočívá v pericyklickém soustředěném rozšíření kruhu. Podle Woodwardových–Hoffmannových pravidel je elektrocyklické otevírání derivátů norkaradienu šestielektronová disrotační (π 4s + σ 2s), tepelně dovolená reakce.

Rovnováha mezi norkaradienem a cykloheptatrienem byla podrobně zkoumána;[10] závisí na sterickém stínění a elektronových a konformačních vlivech. V důsledku vysokého konformačního napětí cyklopropanového kruhu norkaradienu je rovnováha posunuta ve směru k cykloheptatrienu, k norkaradienu ji lze posunout destabilizací cykloheptatrienu skupinami se silným sterickým stíněním, jako je t-butyl, na C1 a C6.

Rovnováhu ovlivňují také substituenty na C7; skupiny dodávající elektrony ji posouvají k norkaradienu, skupiny odtahující elektrony k cykloheptatrienu.
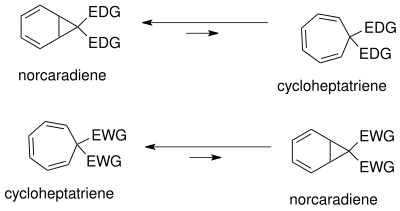
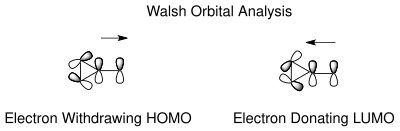
Tautomerizaci mezi norkaradienem a cykloheptatrienem lze vysvětlit Walshovými molekulovými orbitaly cyklopropanové skupiny na norkaradienovém kruhu.[10] Molekulové orbitaly skupin odtahujících elektrony na C7 se překrývají s HOMO Walshovými orbitaly cyklopropanového kruhu, což vede ke zkrácení vazby C1-C6. U skupin dodávajících elektrony probíhá překryv u LUMO, čímž se posiluje protivazebná povaha, která destabilizuje norkaradien.
Využití
[editovat | editovat zdroj]V lékařství
[editovat | editovat zdroj]V roce 1981 použili při zkoumání adicí karbenů na thiofeny Stephen Matlin a Lam Chan Buchnerovo rozšiřování kruhů k přípravě spiroderivátů penicilinu.[11]

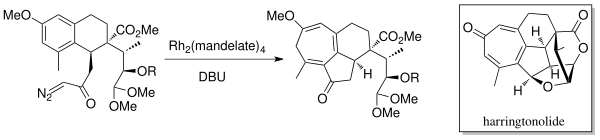
V roce 1998 L. N. Mander et al. připravili diterpenoidový tropon harringtonolid, mající antivirotické vlastnosti, vnitromolekulární Buchnerovou reakcí, kde byly ke tvorbě karbenu použity rhodiový katalyzátor (Rh2(mandelát)4) a 1,8-diazabicyklo(5.4.0)undec-7-en (DBU).[12]
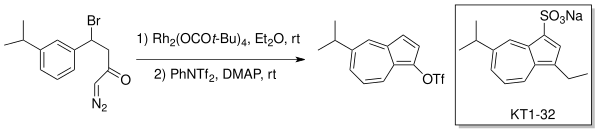
Vnitromolekulární tvorba karbenoidů v rámci Buchnerova rozšiřování byla také využita na přípravu substituovaných azulenů, jako je lék proti vředům egualen (KT1-32); katalyzátorem byl (Rh2(OCOt-Bu)4) rozpuštěný v diethyletheru.[13][14]
Materiálové vědy
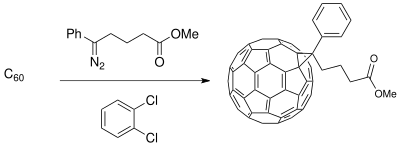
[editovat | editovat zdroj]Buchnerovo rozšiřování kruhů nachází využití ve výrobě výchozích materiálů pro materiálové vědy, například ve fotovoltaických článcích. Vývoj donor-akceptorových rozhraní obsahujících vodivé polymery jako donory a deriváty buckminsterfullerenu jako akceptory vytváří fázově oddělené kompozitní materiály zvyšující fotokonduktivitu fotoindukovaných přenosů náboje ve fotovoltaických článcích.[15]
Na fullereny lze navázat různé funkční skupiny, čímž se zlepší jejich mísitelnost s C60 a tím je možné zlepšit účinnost článků.[16]
Omezení
[editovat | editovat zdroj]Nevýhodami této reakce jsou vedlejší reakce karbenů. Pro reakci je nutné zvolit vhodné rozpouštědlo; například při použití dichlormethanu se objevují inserční reakce na vazbách uhlík-vodík a uhlík-halogen.[17]

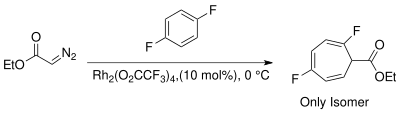
Během navazování karbenu je třeba řídit regioselektivitu reakce, aby se zamezilo tvorbě vedlejších produktů z konjugovaných izomerů cykloheptatrienu. Rhodnatými katalyzátory tvorby karbenů a provedením reakce za pokojové teploty lze dosáhnout regioselektivity ve prospěch kinetického nekonjugovaného cykloheptatrienu.[3][18][19]

Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Buchner ring expansion na anglické Wikipedii.
- ↑ E. Buchner; T. Curtius. Ueber die Einwirkung von Diazoessigather auf aromatisch Kohlenwasserstoffe. Berichte der Deutschen Chemischen Gesellschaft. 1885, s. 2377–2379. Dostupné online. DOI 10.1002/cber.188501802119.
- ↑ E. Buchner; T. Curtius. Synthesis of beta-Keto esters from aldehydes and diazoacetic acid. Berichte der Deutschen Chemischen Gesellschaft. 1885, s. 2371–2377. Dostupné online. DOI 10.1002/cber.188501802118.
- ↑ a b A. J. Hubert; A. F. Noels; A. J. Anciaux; R. Warin; P. Teyssie. Transition-Metal-CatalyzedReactions of Diazo Compounds. 2.' Addition to Aromatic Molecules: Catalysis of Buchner's Synthesis of Cycloheptatrienes. The Journal of Organic Chemistry. 1981, s. 873–876. Dostupné online. DOI 10.1021/jo00318a010.
- ↑ N. E. Searle. Ethyl Diazoacetate. Organic Syntheses. 1956, s. 25. DOI 10.15227/orgsyn.036.0025.
- ↑ a b H. Lebel; J. Marcoux; Molinaro; A. Charette. Stereoselective Cyclopropanation Reactions. Chemical Revíews. 2003, s. 977-1050. DOI 10.1021/cr010007e. PMID 12683775.
- ↑ a b A. McKervey; T. Ye. Organic Synthesis with alpha-Diazocarbonyl Compounds. Chemical Revíews. 1994, s. 1091-1160. DOI 10.1021/cr00028a010.
- ↑ E. E. Wyatt; W. R. J. D. Galloway; D. R. Spring. Regioselectivity in Thermal Rhodium(II)-Catalysed Buchner-Type Reactions of Substituted Aryl Halides: Studies towards the Synthesis of Halide-Substituted Cycloheptatrienes. Synlett. 2011, s. 1449-1453. DOI 10.1055/s-0030-1260562.
- ↑ M. C. Pirrung; H. Liu; J. Morehead; T. Andrew. Rhodium Chemzymes: Michaelis-Menten Kinetics in Dirhodium(II) Carboxylate-Catalyzed Carbenoid Reactions. Journal of the American Chemical Society. 2002, s. 1014-1023. DOI 10.1021/ja011599l. PMID 11829610.
- ↑ P. Yates. The Copper-catalyzed Decomposition of Diazoketones. Journal of the American Chemical Society. 1952, s. 5376-5381. DOI 10.1021/ja01141a047.
- ↑ a b A. R. Maguire; O. A. McNamara. The norcaradieneecycloheptatriene equilibrium. Tetrahedron. 2011, s. 9-40. DOI 10.1016/j.tet.2010.10.030.
- ↑ S. A. Matlin; L. Chan. New spiro derivatives of penicillin. Tetrahedron Letters. 1981, s. 4025-4028. DOI 10.1016/S0040-4039(01)82055-4.
- ↑ L. N. Mander; B. Frey; A. P. Wells; D. H. Rogers. Synthesis of the Unusual Diterpenoid Tropones Hainanolidol and Harringtonolide. Journal of the American Chemical Society. 1998, s. 1914-1915. DOI 10.1021/ja9738081.
- ↑ R. L. Danheiser; J. L. J. Kane; K. M. Shea; A. L. Crombie. Ring Expansion-Annulation Strategy for the Synthesis of Substituted Azulenes and Oligoazulenes. 2. Synthesis of Azulenyl Halides, Sulfonates, and Azulenylmetal Compounds and Their Application in Transition-Metal- Mediated Coupling Reactions. Organic Letters. 2001, s. 1081-1084. DOI 10.1021/ol0156897. PMID 11277800.
- ↑ R. L. Danheiser; A. L. Crombie; J. L. J. Kane; K. M. Shea. A Ring Expansion−Annulation Strategy for the Synthesis of Substituted Azulenes. Preparation and Suzuki Coupling Reactions of 1-Azulenyl Triflates. Organic Letters. 2004, s. 8652-8667. DOI 10.1021/jo048698c. PMID 15575741.
- ↑ G. Yu; J. Gao; J. C. Hummelen; F. Wudl; A. J. Heeger. Polymer Photovoltaic Cells: Enhanced Efficiencies via a Network of Internal Donor-Acceptor Heterojunctions. Science. 1995, s. 1789-1791. DOI 10.1126/science.270.5243.1789. Bibcode 1995Sci...270.1789Y.
- ↑ F. Wudl; J. C. Hummelen; B. W. Knight; F. LePeq. Preparation and Characterization of Fulleroid and Methanofullerene Derivatives. The Journal of Organic Chemistry. 1995, s. 532-538. DOI 10.1021/jo00108a012.
- ↑ C. J. Lovely; R. G. Browning; V. Badarinaray; H. V. Rasika Dias. A silver-catalyzed Buchner reaction. Tetrahedron Letters. 2005, s. 2453-2455. DOI 10.1016/j.tetlet.2005.02.052.
- ↑ S. E. Reisman; R. R. Nani; S. Levin. Buchner and Beyond: Arene Cyclopropanation as Applied to Natural Product Total Synthesis. Synlett. 2011, s. 2437-2442. Dostupné online. DOI 10.1055/s-0031-1289520.
- ↑ W. v. E. Doering; G. Laber; R. Vonderwahl; N. F. Chamberlain; R. B. Williams. The structure of the Buchner Acids. Journal of the American Chemical Society. 1956, s. 5448. DOI 10.1021/ja01601a080.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Buchnerovo rozšiřování kruhů na Wikimedia Commons
Obrázky, zvuky či videa k tématu Buchnerovo rozšiřování kruhů na Wikimedia Commons
