Boronové kyseliny
Boronové kyseliny jsou sloučeniny odvozené od kyseliny borité náhradou jedné ze tří hydroxylových skupin alkylovou nebo arylovou funkční skupinou.[1] Protože tyto sloučeniny obsahují vazbu mezi atomy uhlíku a boru, tak spadají mezi organoborany. Boronové kyseliny fungují jako Lewisovy kyseliny. Jsou jedinečné svou schopností vvratně vytvářet kovalentní komplexy například se sacharidy, aminokyselinami a hydroxyskořicovými kyselinami (molekulami obsahujícími 1,2- nebo 1,3-substituované Lewisovy zásady (alkoholy, aminy, karboxyláty). pKa kyseliny borité je ~9, boronové kyseliny ovšem mohou tvořit tetraedrické komplexy s pKa okolo 7. Používají se například k navazování sacharidů za účelem jejich fluorescenční detekce nebo selektivního transportu přes membrány.
Boronové kyseliny se používají jako stavební prvky a meziprodukty v organické syntéze, nejčastěji při Suzukiových reakcích. Jejich hlavním využitím jsou transmetalace jejich organických zbytků na přechodné kovy.
Sloučenina bortezomib, obsahující tento druh funkční skupiny, se používá při chemoterapii. Atom boru v této molekule blokuje funkci některých proteazomů, které by mohly rozkládat bílkoviny. Boronové kyseliny se vážou na serinová aktivní místa a jsou součástí prasečích inhibitorů pankreatické lipázy,[2] subtilisinu[3] a proteázy Kex2.[4] Deriváty boronových kyselin mohou také inhibovat lidské acylproteinthioesterázy 1 a 2, na které cílí protirakovinná léčiva ze skupiny ras.[5]
Boronové kyseliny mají nízkou toxicitu, což je jedním z důvodů oblíbenosti Suzukiových reakcí při vývoj i a výrobě léčiv. Velká část běžně používaných boronových kyselin a jejich derivátů ovšem vykazuje pozitivní Amesův test a má mutagenní účinky. Mutagenita je pravděpodobně způsobena tvorbou organických radikálů oxidací boronových kyselin vzdušným kyslíkem.[6]
Příprava a struktura
[editovat | editovat zdroj]V roce 1860 popsal Edward Frankland přípravu a izolaci první boronové kyseliny, kyseliny ethylboronové. Nejprve provedl reakci diethylzinku s triethylboritanem za vzniku triethylboranu. Tato látka byla poté oxidována na vzduchu na kyselinu ethylboronovou.[7][8]
Nyní se používá několik různých syntetických postupů a komerčně dostupných je mnoho na vzduchu stálých boronových kyselin.
Boronové kyseliny mají obvykle vysoké teploty tání. Mají tendence tvořit anhydridy odštěpením molekul vody, často tak vznikají cyklické trimery.
| Kyselina | R | Struktura | Molární hmotnost | CAS | Teplota tání °C |
|---|---|---|---|---|---|
| Kyselina fenylboronová | Fenyl |  |
121,93 | 98-80-6 | 216–219 |
| Kyselina 2-thienylboronová | Thiofen |  |
127,96 | 6165-68-0 | 138–140 |
| Kyselina methylboronová | Methyl |  |
59,86 | 13061-96-6 | 91–94 |
| Kyselina cis-propenylboronová | propen | 85,90 | 7547-96-8 | 65–70 | |
| Kyselina trans-propenylboronová | propen |  |
85,90 | 7547-97-9 | 123–127 |
Příprava
[editovat | editovat zdroj]Boronové kyseliny lze získat několika způsoby; nejčastější je reakce organolithných či organohořečnatých sloučenin s estery kyseliny borité.[9][10][11][12]
Příkladem může být příprava kyseliny fenylboronové z fenylmagnesiumbromidu a trimethylborátu následovaná hydrolýzou[13]
- PhMgBr + B(OMe)3 → PhB(OMe)2 + MeOMgBr
- PhB(OMe)2 + H2O → PhB(OH)2 + MeOH
Další možností je transmetalační reakce arylsilanu (RSiR3) s bromidem boritým (BBr3) za vzniku RBBr2 a hydrolýza tohoto meziproduktu.
Třetí způsob spočívá v palladiem katalyzovaných reakcích arylhalogenidů a aryltriflátů s diboronovými estery; tato metoda se nazývá Mijaurova borylace. Místo esterů je možné použít diboronové kyseliny nebo tetrahydroxydibor ([B(OH2)]2).[14][15][16]
Boronové estery
[editovat | editovat zdroj]Boronové estery (také nazývané boronátové estery) jsou estery vytvořené z boronových kyselin a alkoholů nebo fenolů.
| Sloučenina | Funkční vzorec | Strukturní vzorec |
|---|---|---|
| Boronová kyselina | RB(OH)2 |  |
| Ester kyseliny boronové | RB(OR)2 |  |
Tyto sloučeniny lze získat z borátových esterů kondenzací s jednosytnými alkoholy a dioly. Kyselina fenylboronová může podléhat autokondenzaci za vzniku cyklického trimeru nazývaného trifenylboroxin.[17]
| Boronový ester | Alkohol | Strukturní vzorec | Molární hmotnost | Číslo CAS | Teplota varu (°C) |
|---|---|---|---|---|---|
| Pinakolester kyseliny allylboronové | pinakol | 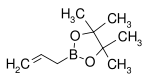 |
168,04 | 72824-04-5 | 50–53 (5 mmHg) |
| Trimethylenglykolester kyseliny fenylboronové | trimethylenglykol |  |
161,99 | 4406-77-3 | 106 (2 mmHg) |
| Diisopropoxymethylboran | isopropylalkohol |  |
144,02 | 86595-27-9 | 105 -107 |
Sloučeniny s pětičlennými cykly obsahujícími řetězce C–O–B–O–C se nazývají dioxaborolany a obdobné sloučeniny s šestičlennými cykly jsou dioxaborinany.
Využití v organické chemii
[editovat | editovat zdroj]Suzukiovy reakce
[editovat | editovat zdroj]Boronové kyseliny se používají při Suzukiových reakcích, kde atomy boru vyměňují své arylové skupiny s alkoxyskupinami navázanými na palladium.
: |
|
() |
Chanovo–Lamovo párování
[editovat | editovat zdroj]Při Chanově–Lamově párování reagují alkyl-, alkenyl-, nebo arylboronové kyseliny se sloučeninami obsahujícími vazby N–H nebo O–H za přítomnosti měďnaté soli, jako je například octan měďnatý, kyslíku a zásady (což může být například pyridin)[18][19] za vzniku nové vazby uhlík-dusík nebo uhlík–kyslík; příkladem může být následující reakce 2-pyridonu s kyselinou trans-1-hexenylboronovou:
Mechanismus reakce zahrnuje deprotonaci aminu, koordinaci aminu na měďnaté centrum, transmetalaci (přesun alkylboronové skupiny na měď a octanu měďnatého na bor), oxidaci Cu2+ na Cu3+ kyslíkem a redukčně eliminační přeměnu Cu3+ na Cu+ za vzniku konečného produktu. Probíhá také přímá redukční eliminace Cu2+ na Cu0, která je ovšem mnohem pomalejší. V katalytických systémech slouží kyslík také k obnově měďnatého katalyzátoru.
Liebeskindovo–Sroglovo párování
[editovat | editovat zdroj]V Liebeskindově–Sroglově párování reagují thioestery s boronovými kyselinami za tvorby ketonů.
Konjugované adice
[editovat | editovat zdroj]Organické zbytky boronových kyselin mohou fungovat jako nukleofily při konjugovaných adičních reakcích, pokud jsou přítomny kovy. Při jedné studii byla provedena reakce pinakolesteru allylboronové kyseliny s dibenzylidenacetonem:[20]
Dalším příkladem konjugované adice je reakce graminu s kyselinou fenylboronovou katalyzovaná dimerem cyklooktadienrhodiumchloridu:[21]
Oxidace
[editovat | editovat zdroj]Boronové estery lze oxidovat na příslušné alkoholy za přítomnosti zásady a peroxidu vodíku.
Homologace
[editovat | editovat zdroj]- Při homologacích boronových esterů se alkylové skupiny přesouvají z boru tvořícího boronát na atom uhlíku:[22]
-
Homologace boronového esteru
-
Využití homologace
Při těchto reakcích se používá dichlormethyllithium na přeměnu boronových esterů v boronáty. Lewisova kyselina následně spustí přesmyk alkylu za odštěpení jednoho chloru. Nakonec organokovová sloučenina, například Grignardovo činidlo, odštěpí druhý atom chloru a RCH2 skupina se naváže na vazbu C-B.
Další reakcí, která zahrnuje přesun alkylboronátu, je Petasisova reakce.
Elektrofilní allylové přesuny
[editovat | editovat zdroj]Allylboronové estery se mohou zapojit do elektrofilních allylových přesmyků, podobně jako sloučeniny křemíku do Sakuraiových reakcí.[23]:
Hydrolýza
[editovat | editovat zdroj]Hydrolýzu boronových esterů na příslušné boronové kyseliny a alkoholy je možné provést například se zapojením thionylchloridu a pyridinu.[24] Arylboronové kyseliny a estery mohou být hydrolyzovány na fenoly působením hydroxylaminu za pokojové teploty.[25]
C–H párovací reakce
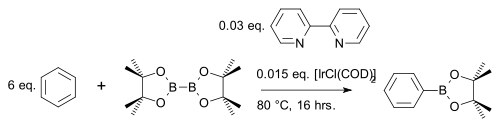
[editovat | editovat zdroj]Sloučenina bis(pinakoláto)dibor[26] reaguje s aromatickými heterocykly[27] nebo jednoduchými areny[28] za tvorby arylboronátových esterů; katalyzátory jsou [IrCl(COD)2] (obměna Crabtreeova katalyzátoru) a zásada 4,4′-di-terc-butyl-2,2′-bipyridin:
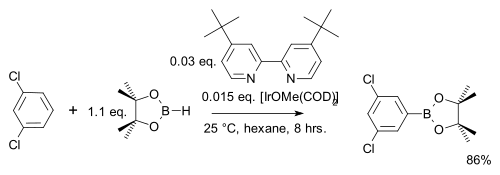
V jedné modifikaci této reakce se používá pouze stechiometrické množství arenu místo velkého přebytku a druhým reaktantem je namísto bis(pinakoláto)diboru levnější pinakolboran:[29]
Na rozdíl od běžné elektrofilní aromatické substituce, kde převažují elektronové efekty, zde regioselektivitu ovlivňují výhradně sterické vlastnosti iridiového komplexu. Příkladem je meta-bromace m-xylenu, u které při běžné variantě vzniká ortho produkt:[30]
Protonolýza
[editovat | editovat zdroj]Protodeborace je chemická reakce, při níž dochází k protonolýze boronové kyseliny (nebo jiné organoboranové sloučeniny) zánikem vazby uhlík-bor a jejím nahrazením vazbou uhlík-vodík. Protodeborace je nežádoucí vedlejší reakcí, často se objevuje při kovy katalyzovaných párovacích reakcích, do kterých jsou zapojené boronové kyseliny (jako je Suzukiova reakce). U dané boronové kyseliny je náchylnost k protodeboraci značně proměnlivá a závisí na mnoha faktorech, jako jsou reakční podmínky a organické substituenty navázané na kyselinu:

Využití v supramolekulární chemii
[editovat | editovat zdroj]Rozlišování sacharidů
[editovat | editovat zdroj]
Kovalentní interakce mezi boronovými kyselinami a hydroxylovými skupinami, například v alkoholech a karboxylovými kyselinami ve vodných roztocích probíhají rychle a jsou vratné. Rovnováha mezi boronovou kyselinou a hydroxylovými skupinami sacharidů může být využita k tvorbě senzorů detekujících přítomnost sacharidů.[32] Jednou z hlavních výhod tohoto postupu je schopnost boronových kyselin překonat problémy spojené s navazováním neutrálních částic ve vodném prostředí.[33] Při správném uspořádání vede přidání terciárního aminu do těchto supramolekulárních systémů k jejich navazování při fyziologickém pH, což umožňuje využití signálních mechanismů, jako je fotoindukovaný přenos elektronu k řízené fluorescenci, která poskytuje údaje o navazování sloučenin.
Tuto metodu je možné použít například v systémech pro sledování obsahu glukózy v krvi u pacientů majících diabetes mellitus. Protože se zde využívají optické senzory, tak je tento způsob jen minimálně invazivní.
Další možností je využití kontaktních čoček obsahujících senzorové molekuly založené na boronových kyselinách k detekci koncentrace glukózy v oční tekutině.[34]
Odkazy
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Boronic acid na anglické Wikipedii.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. DOI 10.1351/goldbook.b00714. (anglicky) DOI: 10.1351/goldbook.
- ↑ C. W. Garner. Boronic acid inhibitors of porcine pancreatic lipase. The Journal of Biological Chemistry. 1980-06-10, s. 5064–5068. ISSN 0021-9258. DOI 10.1016/S0021-9258(19)70749-2. PMID 7372625.
- ↑ R. N. Lindquist; C. Terry. Inhibition of subtilisin by boronic acids, potential analogs of tetrahedral reaction intermediates. Archives of Biochemistry and Biophysics. 1974, s. 135–144. ISSN 0003-9861. DOI 10.1016/s0003-9861(74)80018-4. PMID 4364061.
- ↑ Todd Holyoak; Mark A. Wilson; Timothy D. Fenn; Charles A. Kettner; Gregory A. Petsko; Robert S. Fuller; Dagmar Ringe. 2.4 A resolution crystal structure of the prototypical hormone-processing protease Kex2 in complex with an Ala-Lys-Arg boronic acid inhibitor. Biochemistry. 2003-06-10, s. 6709–6718. ISSN 0006-2960. DOI 10.1021/bi034434t. PMID 12779325.
- ↑ Tobias J. Zimmermann; Marco Bürger; Etsu Tashiro; Yasumitsu Kondoh; Nancy E. Martinez; Kristina Görmer; Sigrid Rosin-Steiner. Boron-based inhibitors of acyl protein thioesterases 1 and 2. ChemBioChem: A European Journal of Chemical Biology. 2013-01-02, s. 115–122. ISSN 1439-7633. DOI 10.1002/cbic.201200571. PMID 23239555.
- ↑ Marvin M. Hansen; Robert A. Jolly; Ryan J. Linder. Boronic Acids and Derivatives—Probing the Structure–Activity Relationships for Mutagenicity. Organic Process Research & Development. 2015-07-29, s. 1507–1516. ISSN 1083-6160. DOI 10.1021/acs.oprd.5b00150.
- ↑ E. Frankland; B. Duppa. On Boric Ethide. Proceedings of the Royal Society. 1860, s. 568–570. DOI 10.1098/rspl.1859.0112.
- ↑ E. Frankland. On a new series of organic compounds containing boron. Journal of the Chemical Society. 1862, s. 363–381. Dostupné online. DOI 10.1039/JS8621500363. Bibcode 1862RSPT..152..167F.
- ↑ Boronic Acids. Příprava vydání Dennis G. Hall. [s.l.]: Wiley, 1862. ISBN 978-3-527-30991-7.
- ↑ KRISTENSEN, Jesper Langgaard; LYSÉN, Morten; VEDSØ, Per; BEGTRUP, Mikael. Synthesis of Ortho Substituted Arylboronic Esters by in situ Traping of Unstable Lithio Intermediates: 2-(5,5-Dimethyl-1,3,2-dioxaborinan-2-yl)benzoic acid ethyl ester. Org. Synth.. 2005, s. 134. Dostupné online.; Coll. Vol.. S. 1015.
- ↑ LI, Wenjie; NELSON, Dorian P.; JENSEN, Mark S.; SCOTT HOERRNER, R.; CAI, Dongwei; LARSEN, Robert D. Synthesis of 3-Pyridylboronic Acid and its Pinacol Ester. Application of 3-Pyridylboronic acid in Suzuki Coupling to Prepare 3-Pyridin-3-ylquinoline. Org. Synth.. 2005, s. 89. Dostupné online.; Coll. Vol.. S. 393.
- ↑ CHARETTE, André B.; LEBEL, Hélène. (2S,3S)-(+)-(3-Phenylcyclopropyl)methanol. Org. Synth.. 1999, s. 86. Dostupné online.; Coll. Vol.. S. 613.
- ↑ WASHBURN, Robert M.; LEVENS, Ernest; ALBRIGHT, Charles F.; BILLIG, Franklin A. Benzeneboronic anhydride. Org. Synth.. 1959, s. 3. Dostupné online.; Coll. Vol.. S. 68.
- ↑ Lukasz T. Pilarski; Kálmán J. Szabó. Palladium-Catalyzed Direct Synthesis of Organoboronic Acids. Angewandte Chemie International Edition. 2011, s. 8230–8232. DOI 10.1002/anie.201102384. PMID 21721088.
- ↑ Gary A. Molander; Sarah L. J. Trice; Spencer D. Dreher. Palladium-Catalyzed, Direct Boronic Acid Synthesis from Aryl Chlorides: A Simplified Route to Diverse Boronate Ester Derivatives. Journal of the American Chemical Society. 2010, s. 17701–17703. DOI 10.1021/ja1089759. PMID 21105666.
- ↑ Tatsuo Ishiyama; Miki Murata; Norio Miyaura. Palladium(0)-Catalyzed Cross-Coupling Reaction of Alkoxydiboron with Haloarenes: A Direct Procedure for Arylboronic Esters. The Journal of Organic Chemistry. 1995-11-01, s. 7508–7510. DOI 10.1021/jo00128a024.
- ↑ WASHBURN, Robert M.; LEVENS, Ernest; ALBRIGHT, Charles F.; BILLIG, Franklin A. Benzeneboronic anhydride. Org. Synth.. 1959, s. 3. Dostupné online.; Coll. Vol.. S. 68.
- ↑ CHAN, Dominic M. T. Copper promoted C–N and C–O bond cross-coupling with phenyl and pyridylboronates. Tetrahedron Letters. 2003, s. 3863–3865. DOI 10.1016/S0040-4039(03)00739-1.
- ↑ LAM, Patrick Y. S. Copper-promoted/catalyzed C–N and C–O bond cross-coupling with vinylboronic acid and its utilities. Tetrahedron Letters. 2003, s. 4927–4931. DOI 10.1016/S0040-4039(03)01037-2.
- ↑ SIEBER, Joshua D. Catalytic Conjugate Addition of Allyl Groups to Styryl-Activated Enones. Journal of the American Chemical Society. 2007, s. 2214–2215. DOI 10.1021/ja067878w. PMID 17266312.
- ↑ GABRIELA. Benzylic Substitution of Gramines with Boronic Acids and Rhodium or Iridium Catalysts †. Organic Letters. 2007, s. 961–964. DOI 10.1021/ol063042m. PMID 17305348.
- ↑ MATTESON, Donald S. 99% Chirally selective synthesis via pinanediol boronic esters: insect pheromones, diols, and an amino alcohol. Journal of the American Chemical Society. 1986, s. 810–819. DOI 10.1021/ja00264a039.
- ↑ PENG, Feng. Simple, Stable, and Versatile Double-Allylation Reagents for the Stereoselective Preparation of Skeletally Diverse Compounds. Journal of the American Chemical Society. 2007, s. 3070–3071. DOI 10.1021/ja068985t. PMID 17315879.
- ↑ MATTESON, Donald S. New asymmetric syntheses with boronic esters and fluoroboranes. Pure Appl. Chem.. 2003, s. 1249–1253. Dostupné online. DOI 10.1351/pac200375091249. S2CID 15944330.
- ↑ KIANMEHR, Ebrahim; YAHYAEE, Maryam; TABATABAI, Katayoun. A mild conversion of arylboronic acids and their pinacolyl boronate esters into phenols using hydroxylamine. Tetrahedron Letters. 2007, s. 2713–2715. DOI 10.1016/j.tetlet.2007.02.069.
- ↑ ISHIYAMA, Tatsuo; MURATA, Miki; AHIKO, Taka-aki; MIYAURA, Norio. Bis(pinacolato)diboron. Org. Synth.. 2000, s. 176. Dostupné online.; Coll. Vol.. S. 115.
- ↑ TAKAGI, Jun. Iridium-catalyzed C–H coupling reaction of heteroaromatic compounds with bis(pinacolato)diboron: regioselective synthesis of heteroarylboronates. Tetrahedron Letters. 2002, s. 5649–5651. DOI 10.1016/S0040-4039(02)01135-8.
- ↑ ISHIYAMA, Tatsuo. Mild Iridium-Catalyzed Borylation of Arenes. High Turnover Numbers, Room Temperature Reactions, and Isolation of a Potential Intermediate. Journal of the American Chemical Society. 2002, s. 390–391. DOI 10.1021/ja0173019. PMID 11792205.
- ↑ ISHIYAMA, Tatsuo. Room temperature borylation of arenes and heteroarenes using stoichiometric amounts of pinacolborane catalyzed by iridium complexes in an inert solvent. Chemical Communications. 2003, s. 2924–5. DOI 10.1039/b311103b. PMID 14680243.
- ↑ MURPHY, Jaclyn M. Meta Halogenation of 1,3-Disubstituted Arenes via Iridium-Catalyzed Arene Borylation. Journal of the American Chemical Society. 2007, s. 15434–15435. DOI 10.1021/ja076498n. PMID 18027947.
- ↑ Jianzhang Zhao; Matthew G. Davidson; Mary F. Mahon; Gabriele Kociok-Köhn; Tony D. James. An Enantioselective Fluorescent Sensor for Sugar Acids. Journal of the American Chemical Society. 2004, s. 16179–16186. DOI 10.1021/ja046289s. PMID 15584754.
- ↑ JAMES, Tony D.; PHILLIPS, Marcus D.; SHINKAI, Seiji. Boronic Acids in Saccharide Recognition. [s.l.]: [s.n.], 2006. ISBN 978-0-85404-537-2. DOI 10.1039/9781847557612.
- ↑ ROWAN, Stuart J.; CANTRILL, Stuart J.; COUSINS, Graham R. L.; SANDERS, Jeremy K. M.; STODDART, J. Fraser. Dynamic Covalent Chemistry. Angewandte Chemie International Edition. 2002, s. 898–952. DOI 10.1002/1521-3773(20020315)41:6<898::AID-ANIE898>3.0.CO;2-E. PMID 12491278.
- ↑ Ocular analyte sensor [online].
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Boronové kyseliny na Wikimedia Commons
Obrázky, zvuky či videa k tématu Boronové kyseliny na Wikimedia Commons

![The Suzuki reaction {\displaystyle {\begin{matrix}{}\\{\ce {{R1-BY2}+R2-X->[{\underset {\text{catalyst}}{\text{Pd}}}][{\text{Base}}]R1-R2}}\\{}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c35df36f38fec8abbc8e9d1d9f04e9b2687ae245)