Mannichova reakce
Mannichova reakce je organická reakce spočívající v aminoalkylaci kyselého protonu umístěného vedle karbonylové funkční skupiny pomocí formaldehydu a amoniaku nebo primárního či sekundárního aminu. Konečnými produkty Mannichových reakcí jsou β-amino-karbonylové sloučeniny, také nazývané Mannichovy zásady. K Mannichovým reakcím se také řadí reakce aldiminů s α-methylenkarbonylovými sloučeninami, protože aldiminy tvoří přechod mezi aminy a aldehydy.
Reakci objevil německý chemik Carl Mannich.[1][2]

Mannichova reakce patří mezi nukleofilní adice aminové skupiny na karbonyl následované dehydratací za tvorby Schiffovy báze. Schiffovy báze jsou poté použity jako elektrofily, které reagují v elektrofilních adicích s molekulami obsahujícími kyselý proton. Mannichova reakce bývá také řazena mezi kondenzační reakce.
Primární nebo sekundární aminy slouží při Mannichově reakci k aktivaci formaldehydu. Terciární aminy nemají vazbu N-H potřebnou k tvorbě enaminového meziproduktu. K nukleofilům s kyselým vodíkem navázaným na uhlík patří karbonylové sloučeniny, nitrily, acetyleny, alifatické nitrosloučeniny, iminy a α-alkyl-pyridiny. Lze rovněž použít aktivované fenylové skupiny a heterocykly s vysokou elektronovou hustotou, jako jsou furany, pyrroly a thiofeny; obzvláště aktivními substráty jsou indoly.
Mechanismus
[editovat | editovat zdroj]Mannichova reakce začíná tvorbou iminiového kationtu z aminu a formaldehydu:

Poté karbonylová sloučenina (zde je použit keton) se může tautomerizovat na enol, který následně reaguje s iminiovým iontem:


U methylketonů může enolizace a následná Mannichova adice proběhnout dvakrát, přičemž poté dojde k β-eliminaci za vzniku derivátů β-aminoenonů.[3][4]
Asymetrické Mannichovy reakce
[editovat | editovat zdroj]Byly také vyvinuty asymetrické Mannichovy reakce. Při správné funkcionalizaci se na ethylenovém můstku produktu Mannichovy reakce vytvoří dvě prochirální centra, která mohou vytvořit dvě dvojice enantiomerů. První asymetrická reakce s nepozměněným aldehydem byla provedena pomocí (S)-prolinu, použitého jako přírodní chirální katalyzátor.[5]
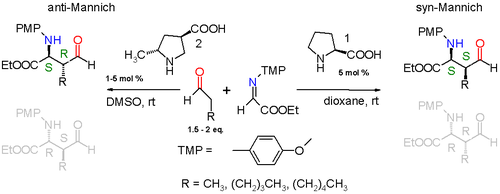
Také byla popsána Mannichova reakce jednoduchého aldehydu (například propionaldehydu) s iminem získaným realci ethylesteru kyseliny glyoxalové s p-methoxyanilinem katalyzovaná (S)-prolinem a prováděná v 1,4-dioxanu při pokojové teplotě. Reakce probíhá diastereospecificky, syn-produkt převažuje nad anti-produktem převažujícím produktem v poměru 3:1, pokud je aldehyd substituován methylovou skupinou, a v poměru 19:1, pokud je substituován pentylovou skupinou. Z obou možných syn-produktů (S,S) a (R,R) se ve větším množství tvoří (S,S)-enantiomer, jehož enantiomerní přebytek je přes 99 %.

Prolin zahajuje katalytický cyklus reakcí s aldehydem za tvorby enaminu. Následně imin reaguje Si-faciálně s enaminem. Z důvodu menšího sterického napětí jsou enaminová a iminová skupina navzájem v antiperiplanární poloze, což vede k výrazné převaze syn-adice nad anti-adicí. Na enantioselektivitu mají také vliv vodíkové vazby mezi karboxylovou skupinou prolinu a iminem. Meziproduktem je devítičlenný cyklus s židličkovou konformací obsahující vazby s přechodnými vlastnostmi mezi jednoduchou a dvojnou vazbou. Nakonec se obnoví prolinová skupina a vytvoří (S,S) produkt.
Pozměněním prolinového katalyzátoru lze dosáhnout i vzniku anti-izomerů.[6]
Při přidání další methylové skupiny na prolin bude meziproduktem desetičlenný cyklus a vznikat bude anti produkt. Diastereoselektivita anti produktů vůči syn-produktům bude přinejmenším v poměru 95:5 a (S,R) enantiomer bude vznikat s nejméně 97% enantiomerním přebytkem.
Využití
[editovat | editovat zdroj]Mannichova reakce se často používá v organické syntéze. Příklady jsou výroba a příprava:
- alkylaminů
- peptidů, nukleotidů, antibiotik a alkaloidů (například tropinonu)
- agrochemikálií, například regulátorů růstu rostlin
- polymerů
- katalyzátorů
- léčiv (například rolitetracyklinu, který je produktem Mannichovy reakce tetracyklinu s pyrrolidinem, fluoxetinu, tramadolu a tolmetinu)
- detergentů
- α,β-nenasycených ketonů tepelným rozkladem produktů Mannichovy reakce (například methylvinylketonu z 1-diethylamino-butan-3-onu)
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Mannich reaction na anglické Wikipedii.
- ↑ C. Mannich; W. Krösche. Ueber ein Kondensationsprodukt aus Formaldehyd, Ammoniak und Antipyrin. Archiv der Pharmazie. 1912, s. 647–667. Dostupné online. doi:10.1002/ardp.19122500151.
- ↑ F. F. Blicke. The Mannich Reaction. Organic Reactions. 2011, s. 303–341. ISBN 978-0471264187. doi:10.1002/0471264180.or001.10.
- ↑ Norman H. Cromwell; David S. Soriano; Earl Doomes. Mobile keto allyl systems. 18. Synthesis and chemistry of N-substituted and N,N-disubstituted 2-benzoyl-1-amino-3-propenes. The Journal of Organic Chemistry. 1980, s. 4983–4985. Dostupné online. doi:10.1021/jo01312a034.
- ↑ Ulrich Girreser; Dieter Heber; Martin Schütt. A Facile One-Pot Synthesis of 1-Aryl-2-(dimethylaminomethyl)prop-2-en-1-ones from Aryl Methyl Ketones. Synthesis. 1998, s. 715–717. doi:10.1055/s-1998-2056.
- ↑ A. Córdova; S.-I. Watanabe; F. Tanaka; W. Notz; C. F. Barbas. A highly enantioselective route to either enantiomer of both α- and β-amino acid derivatives. Journal of the American Chemical Society. 2002, s. 1866–1867. doi:10.1021/ja017833p. PMID 11866595.
- ↑ S. Mitsumori; H. Zhang; P. H.-Y. Cheong; K. Houk; F. Tanaka; C. F. Barbas. Direct asymmetric anti-Mannich-type reactions catalyzed by a designed amino acid. Journal of the American Chemical Society. 2006, s. 1040–1041. doi:10.1021/ja056984f. PMID 16433496.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Mannichova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Mannichova reakce na Wikimedia Commons
