Frustrovaný Lewisův pár
Frustrovaný Lewisův pár (FLP) je sloučenina nebo směs obsahující Lewisovu kyselinu a Lewisovu zásadu, které se v důsledku sterického stínění nemohou spojit do klasického aduktu.[1]
Je znám velký počet FLP, mnoho jednoduchých substrátů vykazuje aktivaci.[2][3]
Rozvoj FLP urychlilo zjištění, že některé z nich uvolňují H2[4]. Jedinečná reaktivita frustrovaných Lewisových párů jim umožňuje reagovat se sloučeninami podléhajícími heterolýze, což například vede k uvolňování vodíku; například směs tricyklohexylfosfinu (PCy3) a tris(pentafluorofenyl)boran uvolňují vodík za vzniku fosfoniových a boritanových iontů:
Tato reaktivita byla využita k vývoji FLP katalyzujících hydrogenační reakce.[5]
Aktivace malých molekul
[editovat | editovat zdroj]Frustrované Lewisovy páry mohou aktivovat řadu malých molekul, buď tím, že spouštějí heterolýzu, nebo tvorbou komplexů.
Vodík
[editovat | editovat zdroj]Aktivace a využití H2 má význam v řadě chemických i biologických procesů. Pomocí FLP lze získat vodík bez použití kovů , čímž se snižují náklady a překonává nevýhoda v podobě nedostatku některých přechodných kovů běžně používaných k aktivacím H2 (Ni, Pd, Pt).[6]
Při reakci tricyklohexylfosfinu (PCy3) s tris(pentafluorofenyl)boritanem vzniká H2 spolu s fosfoniovým a boritanovým iontem:
Při této reakci PCy3 (Lewisova zásada) a B(C6F5)3 (Lewisova kyselina) kvůli sterickým efektům cyklohexylové a pentafluorofenylové skupiny nemohou vytvořit adukt. Proton na fosforu a hydrid na boritanu jsou tak aktivovány a mohou reagovat s organickými sloučeninami a vyvolávat tak hydrogenace.
Mechanismus aktivace divodíku pomocí FLP
[editovat | editovat zdroj]Byl prozkoumán mechanismus aktivace H2 pomocí mezimolekulárních i vnitromolekulárních FLP. Mezimolekulární mají Lewisovu zásadu na jiné molekule než Lewisovu kyselinu, kdy spolu jednotlivé molekuly interagují Londonovými disperzními silami, které k sobě přiblíží Lewisovu zásadu a kyselinu a malé molekuly následně interagují s frustrovanými páry. Experimentální důkazy pro tento druh interakcí nejsou přesvědčivé, byly ovšem získány i další důkazy na základě teorie funkcionálu hustoty. Vnitromolekulární FLP se tvoří při spojení Lewisovy kyseliny a zásady v jedné molekule prostřednictvím kovalentních vazeb. Odolné vnitromolekulární FLP mají reaktivitu nižší v důsledku omezené flexibility.
Ostatní malé molekuly
[editovat | editovat zdroj]FLP kromě H2 reagují i s řadou nenasycených substrátů. Některé vstupují do reakcí s CO2, jako je deoxygenační redukce CO2 na methan.[7]
S frustrovanými Lewisovými páry reaguje také ethen:[8]
Když se pár kyselina-zásada současně chová jako nukleofil i elektrofil, tak lze tuto vlastnost využít pro otevírání kruhů cyklických etherů, jako jsou tetrahydrofuran, 2,5-dihydrofuran, kumaran a dioxan.[9]
Katalytická využití
[editovat | editovat zdroj]Hydrogenace iminů, nitrilů a aziridinů
[editovat | editovat zdroj]Redukce iminů, nitrilů a aziridinů na aminy jsou obvykle katalyzovány hydridy kovů, například hydridem lithno-hlinitým nebo kyanoborohydridem sodným. Lze také použít katalyzátory založené na boritanech fosfoniových iontů, (R2PH)(C6F4)BH(C6F5)2 (R = 2,4,6-Me3C6H2) 1. Tato hydrogenace bez použití kovů může nahradit postupy využívající drahé kovové katalyzátory.
Mechanismus redukce iminů pravděpodobně zahrnuje protonaci dusíkového atomu za tvorby iminiové soli. Rychlost reakce určuje míra zásaditosti dusíku; rychleji se redukují iminy bohatší na elektrony. Vzniklé iminium je nukleofilně atakováno borohydridovým aniontem a vznikne amin. Malé aminy se vážou na boran, čímž zabraňují dalším reakcím; to lze překonat několika způsoby: zvýšením teploty, použitím stericky stínících substituentů na iminech, nebo ochranou iminu pomocí skupiny B(C6F5)3, která také jako Lewisova kyselina usnadňuje reakci.[10]
Enantioselektivní hydrogenace iminů
[editovat | editovat zdroj]Chirální boronátové Lewisovy kyseliny odvozené od (1R)-(+)-kafru vytváří frustrované Lewisovy páry s tBu3P, které lze izolovat jako soli. Tyto FLP katalyzují enantioselektivní hydrogenace některých aryliminů s vysokými výtěžky i enantiomerními přebytky (až 83 %).

Tento postup nelze zobecnit. Silnější sterické efekty u substituentů na iminu vedou k nižším výtěžkům i enantiomerním přebytkům. Nejlepších hodnot se dosahuje u methoxylovaných iminů.[10]
Asymetrické hydrosilylace
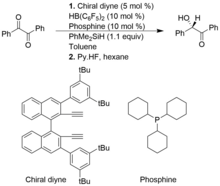
[editovat | editovat zdroj]Frustrované Lewisovy páry chirálních alkenylboranů a fosfinů mohou katalyzovat asymetrické hydrosilylace 1,2-dikarbonylových sloučenin a alfa-ketoesterů s vysokými výtěžnostmi i enantioselektivitami. Oproti běžným Piersovým hydrosilyĺacím ovšem ty asymetrické nejsou příliš rozvinuty.
V následujícím příkladu se vytváří chirální alkenylboran z chirálního diynu a HB(C6F5)2. Heterolytickým štěpením vazby Si-H v molekule PhMe2SiH za katalýzy FLP vzniká komplex silyliového a hydridoboritanového iontu.[11]
Hydrogenace alkynů
[editovat | editovat zdroj]Katalyzátory založené na frustrovaných Lewisových párech lze použít k hydrogenacím neaktivovaných vnitřních alkynů na cis-alkeny.[12]
Tato reakce probíhá za poměrně mírných podmínek, při tlaku vodíku 200 kPa. Z hlediska mechanismu je alkyn nejprve hydroborován a vzniklý vinylboranový FLP poté aktivuje divodík. Následuje protodeborylační krok, kdy se uvolňuje cis-alken (tento izomer vzniká, protože probíhá syn-hydroborylace) a obnovuje katalyzátor. I když se účastní hydrogenací alkynů, tak katalyzátory založené na FLP nekatalyzují hydrogenace alkenů na alkany; v posledním kroku se snadněji štěpí C6F5 než alkyl, což způsobuje rozklad katalyzátoru. Katalytický cyklus se skládá ze tří částí:
- navázání substrátu (hydroborace alkynu)
- štěpení H2 vinylboranem a následné vnitromolekulární protodeborylace vinylové skupiny, kdy se obnovuje N,N-dimethyl-2-[(pentafluorofenyl)boryl]anilin
- vznik cis-alkenu
Při použití vnitřních alkynů dochází k vedlejším reakcím, kdy se proton navázaný na dusík napojuje na fluorobenzeny. Tato adice tak probíhá v menší míře, převažuje ale tvorba alkenu.
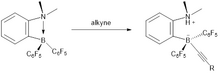
Koncové alkyny se nenavazují na bor hydroboracemi, ale aktivacemi vazeb C-H, napojení protonu na alkynovou skupinu tak vytvoří původní alkyn. Hydrogenace za přítomnosti frustrovaných Lewisových párů tak nelze provést u koncových alkynů, kde vzniká pouze pentafluorbenzen.
Hydrogenace koncových alkynů je možné uskutečnit pomocí systémů tvořených pyridony a borany.[13] Vodík se aktivuje za pokojové teploty a vzniká pyridon-boranový komplex.[14] Disociace tohoto komplexu umožní hydroboraci alkynu volným boranem. Po protodeborylaci pyridonem se utvoří cis-alken. Hydrogenace koncových alkynů zde lze provést z toho důvodu, že aktivace vazby C-H je vratná a probíhá současně s aktivací vodíku.
Borylace
[editovat | editovat zdroj]Aminboranové FLP katalyzují borylace aromatických heterocyklů bohatých na elektrony.[15] Reakci udržuje uvolňování vodíku aktivací vazby C-H pomocí FLP. Aromatické borylace se často používají při vývoji léků, protože sloučeniny boru jsou oproti sloučeninám ušlechtilých kovů lépe dostupné, levnější a méně toxické.

Substráty pro tyto reakce musí splňovat dva základní požadavky, související s mechanismem borylace. Zaprvé musejí být bohaté na elektrony; například samotný thiofen nereaguje, zatímco jeho deriváty bohatší na elektrony, - methoxythiofen a 3,4-ethylendioxythiofen - mohou vstoupit do reakcí s aminy a borany. Substituce 1-methylpyrrolu (který může reagovat) terc-butyloxykarbonylovou (Boc) chránicí skupinou, která způsobuje silné odtahování elektronů, na poloze 2 reakci zcela zastaví. Druhým požadavkem je nepřítomnost zásaditých aminových skupin na substrátu, která by vedla k tvorbě nežádoucího aduktu; tento jev lze ukázat na nereaktivitě pyrrolu, kde se 1-methylpyrrol a N-benzylpyrrol reakce mohou účastnit.
Jednoduchý piperidin jako R skupina aminu (na rozdíl od výše zobrazeného tetramethylpiperidinu) reakci urychluje. Studiemi založenými na kinetice a teorii funkcionálu hustoty bylo zjištěno, že u něj aktivace C-H probíhá snadněji než při použití větších substituentů.[16]
Za podobných podmínek, s použitím N-tosylindolů, lze provádět dearomatizace; jejich produkty jsou syn-hydroborylované indoliny.[17]
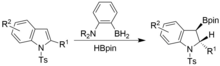
Byly popsány i dehydrogenační borylace vazeb S-H u thiolů. Alkoholy a aminy, jako jsou terc-butanol a terc-butylamin, vytváří stabilní vazby π mezi borem a volným elektronovým párem atomu N/O, které zamezují katalýze, což u thiolů neprobíhá a katalýza tak může probíhat. Provedeny byly i borylace vazeb Se-H; ve všech těchto případech je řídicí silou reakce tvytváření plynného vodíku (H2).[18]
Zachycování uhlíku
[editovat | editovat zdroj]FLP mají využití při zachytávání oxidu uhličitého.[19]
Selektivně zachycovat a uvolňovat oxid uhličitý mohou jak mezimolekulární, tak i vnitromolekulární frustrované Lewisovy páry, složené z fosfinu a boranu. V atmosféře z CO2 FLP za pokojové teploty vytvářejí sloučeninu FLP-CO2 v podobě bílé sraženiny.[19][20]

Zahříváním sloučeniny CO2 s vnitromolekulárním FLP v brombenzenu za teploty 80 °C ve vakuu po 5 hodin vedlo k uvolnění přibližně poloviny CO2 a obnově onou složek FLP. Po několika dalších hodinách ve vakuu za pokojové teploty došlo k uvolnění veškerého CO2.[19]
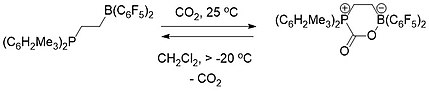
Vnitromolekulární FLP-CO2 je jako pevná látka za pokojové teploty stabilní, ale v dichlormethanovém roztoku se nad -20 °C rozkládá na CO2 a původní FLP.[19]
Tento způsob zachycování se používá v průtokové chemii.[21]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Frustrated Lewis pair na anglické Wikipedii.
- ↑ Douglas W. Stephan. Frustrated Lewis pairs: a concept for new reactivity and catalysis. Organic and Biomolecular Chemistry. 2008, s. 1535–1539. doi:10.1039/b802575b. PMID 18421382.
- ↑ Douglas W. Stephan; Gerhard Erker. Frustrated Lewis Pairs: Metal-free Hydrogen Activation and More. Angewandte Chemie International Edition. 2010, s. 46–76. doi:10.1002/anie.200903708. PMID 20025001.
- ↑ Douglas W. Stephan; Gerhard Erker. Frustrated Lewis pair chemistry. Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences. 2017. doi:10.1098/rsta.2017.0239. PMID 28739971. Bibcode 2017RSPTA.37570239S.
- ↑ Gregory C. Welch; Ronan R. San; Jason D. Masuda; Douglas W. Stephan. Reversible, Metal-Free Hydrogen Activation. Science. 2006, s. 1124–1126. ISSN 0036-8075. doi:10.1126/science.1134230. PMID 17110572. Bibcode 2006Sci...314.1124W.
- ↑ Jolie Lamh; Kevin M. Szkop; Eliar Mosaferi; Douglas W. Stephan. FLP catalysis: main group hydrogenations of organic unsaturated substrates. Chemical Society Reviews. 2018, s. 3592–3612. doi:10.1039/C8CS00277K. PMID 30178796.
- ↑ Gregory C. Welch; Ronan R. San Juan; Jason D. Masuda; Douglas W. Stephan. Reversible, Metal-Free Hydrogen Activation. Science. 2006-11-17, s. 1124–1126. ISSN 0036-8075. doi:10.1126/science.1134230. PMID 17110572. Bibcode 2006Sci...314.1124W.
- ↑ Andreas Berkefeld; Warren E. Piers; Masood Parvez. Tandem Frustrated Lewis Pair/Tris(pentafluorophenyl)borane-Catalyzed Deoxygenative Hydrosilylation of Carbon Dioxide. Journal of the American Chemical Society. 2010-08-11, s. 10660–10661. ISSN 0002-7863. doi:10.1021/ja105320c. PMID 20681691.
- ↑ D. W. Stephan. Frustrated Lewis Pairs: A New Strategy to Small Molecule Activation and Hydrogenation Catalysis. Dalton Transactions. 2009, s. 3129–3136. doi:10.1039/b819621d. PMID 19421613.
- ↑ W. Tochertermam. Structures and Reactions of Organic ate-Complexes. Angewandte Chemie International Edition. 1966, s. 351. doi:10.1002/anie.196603511.
- ↑ a b Dianjun Chen; Yutian Wang; Jürgen Klankermayer. Enantioselective Hydrogenation with Chiral Frustrated Lewis Pairs. Angewandte Chemie International Edition. 2010-12-03, s. 9475–9478. ISSN 1521-3773. doi:10.1002/anie.201004525. PMID 21031385.
- ↑ Xiaoyu Ren; Haifeng Du. Chiral Frustrated Lewis Pairs Catalyzed Highly Enantioselective Hydrosilylations of 1,2-Dicarbonyl Compounds. Journal of the American Chemical Society. 2016-01-15, s. 810–813. ISSN 0002-7863. doi:10.1021/jacs.5b13104. PMID 26750998.
- ↑ Konstantin Chernichenko; Ádám Madarász; Imre Pápai; Martin Nieger; Markku Leskelä; Timo Repo. A frustrated-Lewis-pair approach to catalytic reduction of alkynes to cis-alkenes. Nature Chemistry. 2013, s. 718–723. Dostupné online. doi:10.1038/nchem.1693. PMID 23881505. Bibcode 2013NatCh...5..718C.
- ↑ Felix Wech; Max Hasenbeck; Urs Gellrich. Semihydrogenation of Alkynes Catalyzed by a Pyridone Borane Complex: Frustrated Lewis Pair Reactivity and Boron–Ligand Cooperation in Concert. Chemistry – A European Journal. 2020-09-18. Dostupné online. ISSN 0947-6539. doi:10.1002/chem.202001276.
- ↑ Urs Gellrich. Reversible Hydrogen Activation by a Pyridonate Borane Complex: Combining Frustrated Lewis Pair Reactivity with Boron-Ligand Cooperation. Angewandte Chemie International Edition. 2018, s. 4779–4782. Dostupné online. ISSN 1521-3773. doi:10.1002/anie.201713119.
- ↑ Marc A. Légaré; Marc A. Courtmanche; Étienne Rochette; Frédéric G. Fontaine. Metal-free catalytic C-H bond activation and borylation of heteroarenes. Science. 2015-07-30, s. 513–516. ISSN 0036-8075. doi:10.1126/science.aab3591. PMID 26228143. Bibcode 2015Sci...349..513L.
- ↑ Julien Légaré Lavergne; Arumugam Jayaraman; Luis C. Misal Castro; Étienne Rochette; Frédéric-Georges Fontaine. Metal-Free Borylation of Heteroarenes Using Ambiphilic Aminoboranes: On the Importance of Sterics in Frustrated Lewis Pair C–H Bond Activation. Journal of the American Chemical Society. 2017-10-06, s. 14714–14723. ISSN 0002-7863. doi:10.1021/jacs.7b08143. PMID 28901757.
- ↑ Julien Légaré Lavergne; Luis C. Misal Castro; Vincent Desrosiers; Frédéric-Georges Fontaine. Metal-free borylative dearomatization of indoles: exploring the divergent reactivity of aminoborane C–H borylation catalysts. Chemical Science. 2018, s. 5057–5063. ISSN 2041-6520. doi:10.1039/c8sc01093e. PMID 29938036.
- ↑ Étienne Rochette; Hugo Boutin; Frédéric-Georges Fontaine. Frustrated Lewis Pair Catalyzed S–H Bond Borylation. Organometallics. 2017-06-30, s. 2870–2876. ISSN 0276-7333. doi:10.1021/acs.organomet.7b00346.
- ↑ a b c d Cornelia M. Mömming; Edwin Otten; Gerald Kehr; Roland Fröhlich; Stefan Grimme; Douglas W. Stephan; Gerhard Erker. Reversible Metal-Free Carbon Dioxide Binding by Frustrated Lewis Pairs. Angewandte Chemie International Edition. 2009-08-24, s. 6643–6646. Dostupné online. ISSN 1433-7851. doi:10.1002/anie.200901636. PMID 19569151.
- ↑ Douglas W. Stephan; Gerhard Erker. Frustrated Lewis Pair Chemistry: Development and Perspectives. Angewandte Chemie International Edition. 2015-05-14, s. 6400–6441. ISSN 1433-7851. doi:10.1002/anie.201409800. PMID 25974714.
- ↑ Milad Abolhasani; Axel Günther; Eugenia Kumacheva. Microfluidic Studies of Carbon Dioxide. Angewandte Chemie International Edition. 2014-06-24, s. 7992–8002. ISSN 1433-7851. doi:10.1002/anie.201403719. PMID 24961230.

![{\displaystyle {\ce {PCy3 + B(C6F5)3 + H2 -> [HPCy3]+ [HB(C6F5)3]-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3c7ea46199d1f74478288c7affc7bdd1fc964071)

