Fluorid rtuťný
| Fluorid rtuťný | |
|---|---|
| Systematický název | Fluorid rtuťný |
| Anglický název | Mercury(I) fluoride |
| Německý název | Quecksilber(I)-fluorid |
| Sumární vzorec | Hg2F2 |
| Vzhled | žluté krychlové krystaly |
| Identifikace | |
| Registrační číslo CAS | 13967-25-4 |
| EC-no (EINECS/ELINCS/NLP) | 237-747-9 |
| PubChem | 4084556 |
| SMILES | F[Hg][Hg]F |
| InChI | InChI=1S/2FH.2Hg/h2*1H;;/q;;2*+1/p-2 |
| Vlastnosti | |
| Molární hmotnost | 439,177 g/mol |
| Teplota tání | 570 °C |
| Hustota | 8,37 g/cm3 (pevné skupenství) |
| Součin rozpustnosti | 3,1 . 10−6[1] |
| Bezpečnost | |
| H-věty | H300 H310 H330 H373 H410 |
| P-věty | P260 P301+310 P304+340 P320 P330 P361 P405 P501 |
| NFPA 704 |  0
4
0
|
Některá data mohou pocházet z datové položky. | |
Fluorid rtuťný je chemická sloučenina rtuti a fluoru se vzorcem Hg2F2.[2] Skládá se z malých žlutých krystalů krychlového tvaru, které na světle černají.[3]
Syntéza
[editovat | editovat zdroj]Fluorid rtuťný se připravuje reakcí uhličitanu rtuťného s kyselinou fluorovodíkovou:
Hg2CO3 + 2 HF → Hg2F2 + CO2 + H2O
Reakce
[editovat | editovat zdroj]Fluorid rtuťný po přidání do vody hydrolyzuje na elementární kapalnou rtuť, oxid rtuťnatý a kyselinu fluorovodíkovou:[3]
Hg2F2 + H2O → Hg + HgO + 2 HF
Lze jej použít ve Swartsově reakci k přeměně halogenalkanů na alkylfluoridy:[4]
2 R-X + Hg2F2 → 2 R-F + Hg2X2
Struktura
[editovat | editovat zdroj]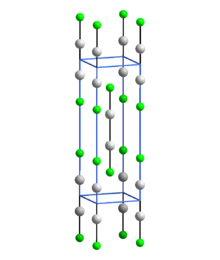
Stejně jako ostatní rtuťné sloučeniny, které obsahují lineární jednotky X-Hg-Hg-X, obsahuje Hg2F2 lineární jednotky FHg2F s délkou vazby Hg-Hg 251 pm (délka Hg-Hg v kovu je 300 pm) a délkou vazby Hg-F 214 pm.[5] Celková koordinace každého atomu rtuti je deformovaný osmistěn.[5] Sloučenina se často formuluje jako Hg 2+
2 2F−.[6]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Mercury(I) fluoride na anglické Wikipedii.
- ↑ RUMBLE, John. CRC Handbook of Chemistry and Physics. 99. vyd. [s.l.]: CRC Press, 2018. Dostupné online. ISBN 978-1138561632. S. 5–189. (anglicky)
- ↑ HRNČÍŘ, Jan. Sloučeniny [online]. Liberec: Gymnázium F. X. Šaldy [cit. 2022-06-05]. Dostupné online.
- ↑ a b PERRY, Dale L.; PHILLIPS, Sidney L. Handbook of Inorganic Compounds. [s.l.]: CRC Press, 1995. "Mercury(I)+fluoride"&pg=PA256&redir_esc=y#v=snippet&q="Mercury(I)%20fluoride"&f=false Dostupné online. ISBN 0-8493-8671-3. S. 256.
- ↑ BEYER, Hans; WALTER, Wolfgang; LLOYD, Douglas. Beyer/Walter Organic Chemistry. [s.l.]: Horwood Publishing "Mercury(I)+fluoride"&pg=PA136&redir_esc=y Dostupné online. ISBN 1-898563-37-3. S. 136.
- ↑ a b WELLS, Alexander Frankj. Structural Inorganic Chemistry. 5. vyd. Oxford: Clarendon Press, 1984. Dostupné online. ISBN 0-19-855370-6.
- ↑ COTTON, F. Albert; WILKINSON, Geoffrey; MURILLO, Carlos A., Manfred Bochmann. Advanced Inorganic Chemistr. 6. vyd. New York: Wiley-Interscience, 1999. Dostupné online. ISBN 0-471-19957-5.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fluorid rtuťný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid rtuťný na Wikimedia Commons



