E1cB reakce

E1cB reakce je eliminační reakce probíhající v zásaditém prostředí, při které se odštěpuje výrazně kyselý vodík, a odděluje se fragment, který není příliš dobrou odstupující skupinou (například -OH nebo -OR). E1cB se skládá ze dvou kroků, přičemž první může, ale nemusí, být vratný. Nejprve zásada odštěpí proton za vzniku stabilizovaného aniontu. Volný elektronový pár se poté z aniontu přesune na sousední atom, což vede k oddělení odstupující skupiny a vzniku dvojné nebo trojné vazby.[1]
E1cB je jedním z konců řady, která vede od E1 a uprostřed se nachází E2 mechanismus. E1 mechanismus je v mnohém jeho opakem: odděluje se při něm dobrá odstupující skupina (jako je -OTs nebo -Br), zatímco kyselost vodíku je nízká a navíc není přítomna solná zásada. Při E1 mechanismu nejprve oddělením odstupující skupiny vznikne karbokation. Meziprodukt, který poté zůstane, má prázdný orbital p, čímž se vodík na sousedním uhlíku stává mnohem kyselejším, a ve druhém kroku jej tak může odštěpit i slabá zásada. V E2 reakci přítomnost silné zásady a dobré odstupující skupiny dovoluje současný průběh odštěpení protonu a odstupující skupiny, a reakce tak probíhá v jediném kroku.
Mechanismus
[editovat | editovat zdroj]
K tomu, aby reakce proběhla E1cB mechanismem, je nutné splnění dvou podmínek. První je přítomnost kyselého vodíku na β-uhlíku, druhou slabá odstupující skupina na α-uhlíku. Prvním krokem E1cB mechanismu je deprotonace β-uhlíku, která vytvoří aniontový meziprodukt; čím stálejší je tento meziprodukt, tím pravděpodobnější je průběh reakce E1cB mechanismem, stabilizován může být indukcí nebo delokalizací volného elektronového páru na rezonančních strukturách. Obecně E1cB mechanismus vyvolává kombinace skupiny odtahující elektrony na substrátu, silné zásady, slabé odstupující skupiny, a polárního rozpouštědla. Příkladem E1cB reakce se stabilním meziproduktem je rozklad karbamátového insekticidu ethiofenkarbu, který na vzduchu probíhá poměrně rychle; po deprotonaci aminu je vzniklý amid poměrně stálý, jelikož je konjugován se sousedícím karbonylem. Odstupující skupina nesmí být příliš silná, protože by se jinak oddělila již před ionizací molekuly a eliminace by proběhla E2 mechanismem. Ke sloučeninám se špatnými odstupujícími skupinami patří například alkoholy a fluoralkany.
E1cB mechanismus je u eliminací alkenů na alkyny častější než u eliminací alkanů na alkeny,[2] což je možné vysvětlit tím, že protony navázané na sp2-hybridizované uhlíky jsou o něco kyselejší než ty na sp3-uhlících. E1cB mechanismus není omezen jen na eliminace uhlíkatých sloučenin, byl také pozorován na heteroatomech, jako je například dusík, na kterém k tomuto druhu eliminace dochází při tvorbě fenolového derivátu z ethiofenkarbu.[3]

Rozdíly mezi E1cB, E1-, a E2 eliminacemi
[editovat | editovat zdroj]Při eliminačních reakcích se odštěpují dva substituenty z dvojice atomů v molekule, čímž se vytvářejí alkenové, alkynové, či obdobné heteroatomové (například karbonylové a kyano) skupiny. E1cBje jen jedním z druhů eliminačních reakcí, vedle E1 (jednomolekulárních) a E2 (bimolekulárních). Přestože jsou jejich mechanismy podobné, tak se liší v průběhu deprotonace α-uhlíku a oddělení odstupující skupiny.
U E1 mechanismu se dobrá odstupující skupina oddělí před deprotonací, čímž vznikne karbokation, který je poté deprotonován za vzniku nové vazby pí. Kromě dobré odstupující skupiny, jako je brom nebo chlor, také musí molekula obsahovat α-uhlík, který není příliš kyselý.

Při E2-reakci proběhnou deprotonace α-uhlíku a odštěpení odstupující skupiny současně v jednom soustředěném kroku. Molekuly procházející tímto druhem eliminace mají kyselejší α-uhlíky než ty, jež vstupují do E1-reakcí, ale jejich α-uhlíky jsou méně kyselé než u molekul přeměňujících se E1cB mechanismem. Hlavním rozdílem mezi E1cB a E2 je samostatná tvorba karboaniontového meziproduktu u prvního mechanismu a soustředěný průběh u druhého. Mechanismy se mohou lišit i při použití jiných halogenových odstupujících skupin; například chlor stabilizuje anion lépe než fluor,[4]a odděluje se tak, přestože je chlor lepší odstupující skupinou.[5] Tímto se dokazuje, že reakce probíhá přes karboanion, protože získané produkty nemohly vzniknout soustředěným mechanismem (E2).
V následující tabulce jsou shrnuty hlavní rozdíly mezi jednotlivými druhy eliminačních reakcí; určení, kterým mechanismem probíhá daná reakce, se ovšem nejsnáze provádí s využitím chemické kinetiky.
| E1 | E2 | E1cB |
|---|---|---|
| Postupná reakce | Soustředěná reakce | Postupná reakce |
| Karbokationtový meziprodukt | Současný průběh odštěpení protonu, vzniku dvojné vazby, a oddělení odstupující skupiny | Karbokationtový meziprodukt |
| Silně kyselé prostředí | Nezáleží na kyselosti či zásaditosti | Silně zásadité prostředí |
| Dobré odstupující skupiny | Odstupující skupiny | Špatné odstupující skupiny |
| Méně kyselý β-vodík | Kyselý β-vodík | Více kyselý β-vodík |
Kinetika
[editovat | editovat zdroj]K určení, zda reakce probíhá E1cB mechanismem, je potřeba chemická kinetika. Nejvhodnějšími prostředky k určování mechanismů reakcí jsou rychlostní rovnice a kinetický izotopový efekt.
Rychlostní rovnice
[editovat | editovat zdroj]E1cB mechanismus se nejlépe zjišťuje pomocí rychlostní rovnice a kinetického izotopového efektu.
Vliv E1cB mechanismu na rychlost reakce se určuje poměrně snadno; vychází se při tom z tohoto obecného průběhu:
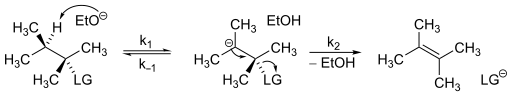
Za předpokladu stálé koncentrace karboaniontu vypadá rychlostní rovnice takto:
Z rovnice je zřejmé, že reakce probíhá podle kinetiky druhého řádu.[6]
Kinetiky E1cB reakcí se mohou, podle rychlosti jednotlivých kroků, mírně lišit; E1cB mechanismus tak lze rozdělit do tří skupin:[7]
- E1cBanion kde je karboanion stálý a/nebo se používá nadbytek silné zásady, deprotonace je tak nevratná a rychlost určuje oddělování odstupující skupiny (k1[b] ≫ k2).
- E1cBrev kde je první krok vratný, ale tvorba produktu je pomalejší než obnova výchozích látek, což znovu vede k pomalému druhému kroku (k−1[con a] ≫ k2).
- E1cBirr nastává, jestliže je první krok pomalý, ale po vzniku aniontu již tvorba produktu probíhá rychle (k2 ≫ k−1[con a]). První krok je pak nevratný a rychlost určuje deprotonace.
Kinetický izotopový efekt
[editovat | editovat zdroj]Deuterium
[editovat | editovat zdroj]Kinetický izotopový efekt deuteria umožňuje rozlišit mezi E1cBrev, E1cBanion, a E1cBirr. Pokud je rozpouštědlo protické a obsahuje deuterium namísto lehkého vodíku (například CH3OD), tak lze sledovat přesun vodíkových iontů do výchozího materiálu. Pokud obnovený výchozí materiál obsahuje deuterium, tak reakce pravděpodobně probíhá E1cBrev mechanismem; protože je při něm protonace karbaniontu (konjugovanou kyselinou nebo rozpouštědlem) rychlejší než oddělování odstupující skupiny, tak po svém vzniku karboanion rychle odštěpuje proton z rozpouštědla za obnovení výchozí látky.
Jestliže reaktant obsahuje deuterium v poloze β, tak tím primární kinetický izotopový efekt ukazuje, že rychlost určuje deprotonace, reakce tedy probíhá E1cBirr mechanismem, protože při E1cBanion je tento izoto již oddělen a u E1cBrev rychlost určuje odvazování odstupující skupiny.
Fluor-19 a uhlík-11
[editovat | editovat zdroj]Mezi jednotlivými mechanismy E1cB lze rozlišit také pomocí 19F. Fluor je poměrně špatnou odstupující skupinou, a často se zapojuje do E1cB mechanismů. Tímto postupem je možné zjistit, jestli je krokem určujícím rychlost odvazování odstupující skupiny a pomáhá rozlišit mezi E1cBirr a E2. Ke zkoumání přechodného stavu je možné použít 11C. 11C dovoluje zkoumat tvorbu karboaniontu a jeho životnost, čímž lze rozlišit dvoukrokový E1cB a soustředěný E2 mechanismus, přičemž údaje o stabilitě přechodného stavu mohou být použity k určení konkrétního druhu E1cB mechanismu.[8]
Aldolové reakce
[editovat | editovat zdroj]Nejrozšířenějším druhem reakce zahrnujícím E1cB eliminaci je aldolová kondenzace v zásaditém prostředí, kde se deprotonuje karbonylová sloučenina za vzniku enolátu. Enolát následně slouží jako nukleofil a může atakovat elektrofilní karbonyl. Aldolový produkt se poté deprotonuje za tvorby dalšího enolátu a následně se odštěpí voda E1cB dehydratací.[9]

Fotoindukované E1cB reakce
[editovat | editovat zdroj]Byla popsána i fotochemická E1cB reakce,[10] kdy byl karboanion vytvořen fotochemickou dekarboxylací, a poté se oddělila odstupující skupina. Od ostatních E1cB se tato reakce odlišuje tím, že ke vzniku karboaniontu nepotřebuje zásadu. Karboanion se vytvářel nevratně, takže lze tento děj označit jako E1cBirr.

V biologii
[editovat | editovat zdroj]Eliminační reakce s E1cB mechanismem jsou důležitými součástmi biochemických procesů; příkladem může být předposlední krok glykolýzy, kde se působením enzymu enolázy mění 2-fosfoglycerát na fosfoenolpyruvát.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku E1cB-elimination reaction na anglické Wikipedii.
- ↑ R. B. Grossman. The Art of Writing Reasonable Organic Mechanisms. [s.l.]: Springer, 2008. Dostupné online. ISBN 978-0-387-95468-4. S. 53–56.
- ↑ Michael Smith. March's advanced organic chemistry reactions, mechanisms, and structure. [s.l.]: Wiley-Interscience, 2007. ISBN 978-1-61583-842-4. S. 1488–1493.
- ↑ Randa Ouertani; Latifa Latrous El Atrache; Nejib Ben Hamida. Alkaline hydrolysis of ethiofencarb: Kinetic study and mechanism degradation. International Journal of Chemical Kinetics. 2013, s. 118–124. ISSN 0538-8066. DOI 10.1002/kin.20748.
- ↑ Jack Hine; Norbert W. Burske; Mildred Hine; Paul B. Langford. The Relative Rates of Formation of Carbanions by Haloforms. Journal of the American Chemical Society. 1957, s. 1406–1412. ISSN 0002-7863. DOI 10.1021/ja01563a037.
- ↑ Enrico Baciocchi; Renzo Ruzziconi; Giovanni Vittorio Sebastiani. Concerted and stepwise mechanisms in the eliminations from 1,2-dihaloacenaphthenes promoted by potassium tert-butoxide and potassium ethoxide in the corresponding alcohols. The Journal of Organic Chemistry. 1982, s. 3237–3241. DOI 10.1021/jo00138a007.
- ↑ D. J. McLennan. The carbanion mechanism of olefin-forming elimination. Quarterly Reviews, Chemical Society. 1967, s. 490. ISSN 0009-2681. DOI 10.1039/qr9672100490.
- ↑ Michael Smith. March's advanced organic chemistry reactions, mechanisms, and structure. [s.l.]: Wiley-Interscience, 2007. ISBN 978-1-61583-842-4. S. 1488–1493.
- ↑ Olle Matsson; Susanna MacMillar. Isotope effects for fluorine-18 and carbon-11 in the study of reaction mechanisms. Journal of Labelled Compounds and Radiopharmaceuticals. 2007, s. 982–988. DOI 10.1002/jlcr.1443.
- ↑ L. G. Wade. Organic Chemistry. [s.l.]: Prentice Hall, 2005. ISBN 0-13-236731-9. S. 1056–1066.
- ↑ Matthew Lukeman; Juan C. Scaiano. Carbanion-Mediated Photocages: Rapid and Efficient Photorelease with Aqueous Compatibility. Journal of the American Chemical Society. 2005, s. 7698–7699. ISSN 0002-7863. DOI 10.1021/ja0517062. PMID 15913358.

![Rychlostní rovnice a pozorovaná rychlost E1cB mechanismu za použití ethoxidu jako zásady {\displaystyle {\begin{aligned}{\frac {\ce {d[P]}}{{\ce {d}}t}}&={\frac {k_{1}k_{2}{\ce {[sub][b]}}}{k_{-1}[{\ce {con\ a}}]+k_{2}}}\\{\ce {rychlost}}&=k_{\ce {obs}}{\ce {[sub][b]}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/671975ca79fee4f6c831afa7d2a18ce505313110)