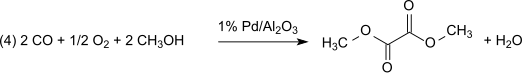Dimethyl-oxalát
| Dimethyl-oxalát | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | dimethyl-oxalát |
| Funkční vzorec | CH3OC(=O)C(=O)OCH3 |
| Sumární vzorec | C4H6O4 |
| Vzhled | bezbarvá pevná látka[1] |
| Identifikace | |
| Registrační číslo CAS | 553-90-2 |
| EC-no (EINECS/ELINCS/NLP) | 209-053-6 |
| PubChem | 11120 |
| SMILES | O=C(OC)C(=O)OC |
| InChI | InChI=1S/C4H6O4/c1-7-3(5)4(6)8-2/h1-2H3 |
| Vlastnosti | |
| Molární hmotnost | 118,09 g/mol |
| Tlak páry | 152 Pa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H314 H315 H318 H319[1] |
| P-věty | P260 P264+265 P270 P280 P301+317 P301+330+331 P302+352 P302+361+354 P304+340 P305+351+338 P305+354+338 P316 P317 P321 P330 P332+317 P337+317 P362+364 P363 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Dimethyl-oxalát je organická sloučenina se vzorcem (CO2CH3)2, dimethylester kyseliny šťavelové; jedná se o bezbarvou pevnou látku rozpustnou ve vodě.
Výroba
[editovat | editovat zdroj]Dimethyloxalát lze získat esterifikací kyseliny šťavelové methanolem za katalýzy kyselinou sírovou:[2]
Oxidační karbonylace
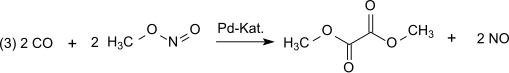
[editovat | editovat zdroj]Při oxidační karbonylaci postačují k výrobě dimethyloxalátu jednouhlíkaté výchozí látky:[3]
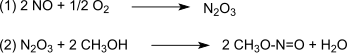
Reakci katalyzuje Pd2+.[4][5][6][7][8] Syntézní plyn se obvykle získává z uhlí nebo biomasy. V průběhu oxidace se vytváří reakcí oxidu dusnatého a kyslíku oxid dusitý (1), který následně reaguje s methanolem (2) za tvorby methylnitritu:[9]
Následuje dikarbonylace methylnitritu oxidem uhelnatým (3) katalyzovaná palladiem, kterou vzniká za atmosférického tlaku a teploty 80-120 °C plynný dimethyloxalát:
Souhrnná rovnice vypadá takto:
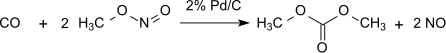
Při tomto postupu nedochází ke ztrátám methylnitritu, který slouží jako nosič oxidačního činidla; je ovšem třeba odstraňovat vznikající vodu, aby nedocházelo k hydrolýze produktu. Při použití 1 % Pd/α-Al2O3 se vytváří dimethyloxalát dikarbonylací, za stejných podmínek s 2 % Pd/C dochází k monokarbonylaci:
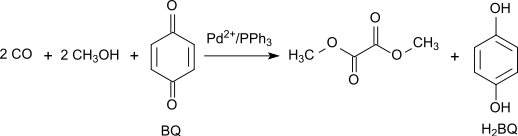
Lze také použít oxidační karbonylaci methanolu 1,4-benzochinonem za katalýzy octanem palladnatým a trifenylfosfinem, ta se vyznačuje vysokými hodnotami výtěžnosti i selektivity. Vhodný poměr octanu, fosfinu a benzochinonu činí 1:3:100, teplota 65 °C a tlak oxidu uhelnatého 7 MPa:[8]
Reakce
[editovat | editovat zdroj]Dimethyloxalát se, stejně jako odpovídající diethylester, používá v řadě různých kondenzačních reakcí,[10] například s cyklohexanonem vytváří diketoester, ze kterého lze získat kyselinu pimelovou.[11] Reakcemi diesterů kyseliny šťavelové s diaminy vznikají cyklické diamidy. Kondenzací dimethyloxalátu a o-fenylendiaminu se utváří chinoxalindion:
- C2O2(OMe)2 + C6H4(NH2)2 → C6H4(NHCO)2 + 2 MeOH
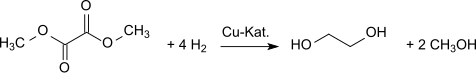
Hydrogenací se dimethyloxalát mění na ethylenglykol.[12] Tuto přeměnu lze provést s 94,7% výtěžností.[13][14][15]
Vzniklý methanol se zapojuje do oxidační karbonylace.[16]
Dekarbonylací se z dimethyloxalátu stává dimethylkarbonát.[17]
Transesterifikační reakcí s fenolem za přítomnosti sloučenin titanu se vyrábí difenyloxalát,[18][19][20] který se, v kapalné nebo plynné fázi, dekarbonyluje na difenylkarbonát.
Dimethyloxalát lze použít také jako methylační činidlo. Vyznačuje se nižší toxicitou, než další methylační činidla, jako jsou jodmethan a dimethylsulfát.[10]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Dimethyl oxalate na anglické Wikipedii.
- ↑ a b c d e https://pubchem.ncbi.nlm.nih.gov/compound/11120
- ↑ Everett Bowden. Methyl Oxalate. Organic Syntheses. 1930, s. 78. doi:10.15227/orgsyn.010.0078.
- ↑ Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte, S. 168; ISBN 978-3-527-31540-6
- ↑ US4467109A Process for continuous preparation of diester of oxalic acid. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ EP0108359A1 Process for the preparation of a diester of oxalic acid.. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ EP0425197A2 Process for preparing diester of carbonic acid.. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ US4451666A Synthesis of oxalate esters by the oxidative carbonylation of alcohols with a heterogeneous manganese promoted Pd-V-P catalyst. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ a b E. Amadio: Oxidative Carbonylation of Alkanols Catalyzed by Pd(II)-Phosphine Complexes, PhD Thesis, Ca’Foscari University Venice, 2009
- ↑ X.-Z. Jiang, Palladium Supported Catalysts in CO + RONO Reactions, Platinum Metals Rev., 1990, 34, (4), 178–180
- ↑ a b Jan Bergman; Per-Ola Norrby; Peter Sand. Alkylation with Oxalic Esters. Scope and mechanism. Tetrahedron. 1990, s. 6113–6124. doi:10.1016/S0040-4020(01)87933-3.
- ↑ H. R. Snyder; L. A. Brooks; S. H. Shapiro; A. Müller. Pimelic Acid. Organic Syntheses. 1931, s. 42. doi:10.15227/orgsyn.011.0042.
- ↑ Coal to MEG, Changing the Rules of the Game [online]. [cit. 2016-08-08]. Dostupné v archivu pořízeném z originálu dne 2011-07-14.
- ↑ Process for continuously preparing ethylene glycol. Původci vynálezu: Susumu TAHARA, Kozo FUJII, Keig NISHIHIRA. US. Patentový spis US4453026A. 1984-06-05. Dostupné: <online> [cit. 2023-12-24].
- ↑ TEUNISSEN, Herman T.; ELSEVIER, Cornelis J. Ruthenium catalysed hydrogenation of dimethyl oxalate to ethylene glycol. Chemical Communications. 1997, čís. 7, s. 667–668. Dostupné online [cit. 2023-12-24]. doi:10.1039/a700862g.
- ↑ S. Zhang et al., Highly-Dispersed Copper-Based Catalysts from Cu–Zn–Al Layered Double Hydroxide Precursor for Gas-Phase Hydrogenation of Dimethyl Oxalate to Ethylene Glycol, Catalysis Letters, Sept. 2012, 142 (9), 1121–1127, DOI:10.1007/s10562-012-0871-8
- ↑ Individual news [online]. Dostupné online.
- ↑ US4544507A Production of carbonate diesters from oxalate diesters. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ US5834614A Method for producing a fluorine-containing silicone compound. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ Process for producing diaryl carbonates. Původci vynálezu: Zhen Wei HUANG, Chih Wei CHANG, Chia Jung TSAI. US. Patentový spis US8212066B2. 2012-07-03. Dostupné: <online> [cit. 2024-09-25]. (anglicky)
- ↑ MA, Xinbin; GUO, Hongli; WANG, Shengping. Transesterification of dimethyl oxalate with phenol over TS-1 catalyst. Fuel Processing Technology. 2003-09-15, roč. 83, čís. Advances in C1 Chemistry in the Year 2002, s. 275–286. Dostupné online [cit. 2024-09-25]. ISSN 0378-3820. doi:10.1016/S0378-3820(03)00075-4.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Dimethyl-oxalát na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dimethyl-oxalát na Wikimedia Commons