Cheletropní reakce
Cheletropní reakce, také nazývané chelotropní reakce[1] jsou jedním z druhů pericyklických reakcí, konkrétně se jedná o reakce, při kterých se vytváří meziprodukt s cyklicky uspořádanými atomy a obdobným uspořádáním interagujících orbitalů; v těchto cyklických strukturách přitom dochází k překládání vazeb σ a π.[2]
Cheletropní reakce jsou, obecněji řečeno, podskupinou cykloadicí. Od ostatních se liší tím, že u jedné z reagujících látek vznikají obě nové vazby na stejném atomu.[3] Na obrázku vpravo je znázorněno několik příkladů, prvním příkladem je to karbonylový uhlík, který vytvoří oxid uhelnatý. U dalších dvou se odštěpuje malá stabilní molekula. Reakce často probíhají díky tomu, že je vývin plynu (například CO nebo N2) entropicky výhodný.[2]
Teoretická analýza
[editovat | editovat zdroj]V pericyklickém meziproduktu malá molekula dodává do cyklu dva elektrony. Reakci lze popsat za použití dvou různých geometrií, lineární nebo nelineární. Při lineární se elektrony v orbitalu této molekuly nachází přímo v π systému. Při nelineárním se orbitaly přibližují pod určitým úhlem. Schopnost π systému rotovat při přibližování malé molekuly je pro tvorbu nových vazeb důležitá. Na níže zobrazeném diagramu dvouelektronová částice reaguje s čtyřelektronovým π systémem; ke znázornění jsou využity hraniční molekulové orbitaly. Pokud se malá molekula přibližuje lineárně, reakce bude disrotační, při nelineárním přiblížení bude konrotační.
Pomocí Hückelova pravidla lze určit, zda je π systém aromatický či antiaromatický. Je-li aromatický, tak při lineárním přístupu molekuly dojde k disrotační a při nelineárním přístupu ke konrotační reakci; v případě antiaromatického π systému je to naopak.[2]
Cheletropní reakce s účastí SO2
[editovat | editovat zdroj]Termodynamika
[editovat | editovat zdroj]V roce 1995 bylo, na základě experimentů a výpočetních postupů, zjištěno, že oxid siřičitý reaguje s buta-1,3-dienem a izoprenem za vzniku různých produktů, které záleží na mechanismu reakce. Může vznikat kinetický i termodynamický produkt, ovšem termodynamický se tvoří ve větším množství. Kinetický produkt vzniká Dielsovou–Alderovou reakcí, zatímco cheletropní reakce vytváří termodynamicky stabilnější produkt. Cheletropní mechanismus je upřednostňován, protože vzniká stabilnější pětičlenný cyklus. Na následujícím obrázku je znázorněn rozdíl mezi těmito produkty, v reakci vpravo vzniká termodynamický produkt, zatímco v reakci vlevo kinetický produkt.[4]
Kinetika
[editovat | editovat zdroj]Cheletropní reakce 1,3-dienů s oxidem siřičitým byly podrobně zkoumány s ohledem na kinetiku.
První kvantitativní měření parametrů těchto reakcí proběhlo roku 1976, kdy byly zkoumány parametry reakcí SO2 s deriváty buta-1,3-dienu. Rychlosti adicí byly měřeny v benzenu při 30 °C s počátečním dvacetinásobným nadbytkem oxidu siřičitého; jeho úbytek byl měřen spektrofotometricky při 320 nm. Ukázalo se, že kinetika odpovídá reakci pseudoprvního řádu. Bylo taktéž zjištěno, že substituenty butadienu snižující elektronovou hustotu reakci zpomalují. Reakční rychlost byla také významně ovlivňována sterickými vlivy 2-substituentů, kde objemnější skupiny reakci zrychlovaly. Velké skupiny mají tendenci upřednostňovat cisoidní konformaci dienu. U sedmi z použitých dienů byly reakční rychlosti měřeny při čtyřech různých teplotách, což umožnilo spočítat entalpii aktivace (ΔH‡) a entropii aktivace (ΔS‡) u každé reakce z Arrheniovy rovnice.[5]
| -butadien | 104 k /min−1 (30 °C) (± 1-2%) absolutní | 104 k /min−1 (30 °C) (± 1-2%) relativní | ΔH‡ /kJ mol−1 | ΔS‡ /J mol−1 K−1 |
|---|---|---|---|---|
| 2-methyl | 1,83 | 1,00 | 62,4 | -63 |
| 2-ethyl | 4,76 | 2,60 | 44,4 | -96 |
| 2-isopropyl | 13,0 | 7,38 | 52,3 | -71 |
| 2-terc-butyl | 38,2 | 20,8 | 41,9 | -80 |
| 2-neopentyl | 17,2 | 9,4 | 48,6 | -75 |
| 2-chlor | 0.24 | 0.13 | ||
| 2-bromethyl | 0,72 | 0,39 | ||
| 2-p-tolyl | 24,7 | 13,5 | 43,5 | -80 |
| 2-fenyl | 17,3 | 9,45 | ||
| 2-(p-bromfenyl) | 9,07 | 4,96 | ||
| 2,3-dimethyl | 3,54 | 1,93 | 51,5 | -75 |
| cis-1-methyl | 0,18 | 0,10 | ||
| trans-1-methyl | 0,69 | 0,38 | ||
| 1,2-dimethylen-cyclohexan | 24,7 | 13,5 | 47,7 | -67 |
| 2-methyl-1,1,4,4-d4 | 1,96 |
V rámci další studie, z roku 2002, byla měřena kinetika adicí SO2 na 1,2-dimethylidencykloalkany. Bylo přitom mimo jiné zjištěno, že reakcí 1,2-dimethylidencyklohexanu s oxidem siřičitým mohou, v závislosti na podmínkách, vznikat dva různé produkty. Při kinetické hetero-Dielsově–Alderově reakci (≤ -60 °C) vzniká odpovídající sultin, zatímco při termodynamické reakci (≥ -40 °C) se cheletropní reakcí vytváří příslušný sulfolen. Aktivační energie hetero-Dielsovy–Alderovy reakce je asi o 8 kJ/mol nižší než u příslušné cheletropní reakce. Sulfolen je v CH2Cl2/SO2 asi o 40 kJ/mol stabilnější než odpovídající sultin.[6]
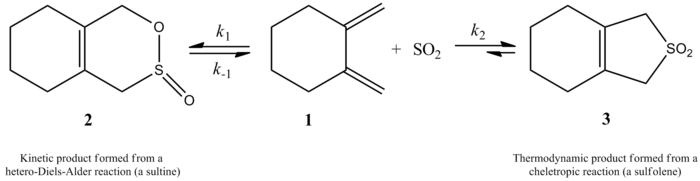
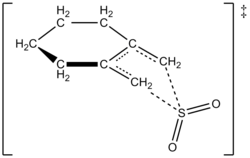
Bylo zjištěno, že je reakce u 1,2-dimethylidencyklohexanu prvního řádu, ovšem u oxidu siřičitého je druhého řádu, což odpovídá kvantovým výpočtům; pomocí nich byla také navržena struktura meziproduktu cheletropní reakce 1,2-dimethylidencyklohexanu s oxidem siřičitým.[6] U oxidu siřitého jde o reakci druhého řádu, jelikož se další molekula této látky váže na meziprodukt, čímž jej stabilizuje.[7] Podobné výsledky byly získány v rámci jiné studie z roku 1995, kdy byly použity kvantově mechanické výpočty ke zkoumání termodynamicky a kineticky ovládané reakce oxidu siřičitého s 1,3-dieny.[4]
Vliv rozpouštědla
[editovat | editovat zdroj]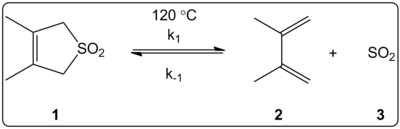
U 14 různých rozpouštědel byl zkoumán jejich vliv na kinetiku cheletropních reakcí 3,4-dimethyl-2,5-dihydrothiophen-1,1-dioxidu. Bylo zjištěno, že reakční konstanty přímých a zpětných reakcí, stejně jako rovnovážné konstanty souhlasí s polaritou těchto látek podle stupnice ET(30).
Reakce byly prováděny při 120 °C a zkoumány 1H-NMR spektroskopií reakční směsi. Rychlostní konstanta přímé reakce k1 se při postupu od cyklohexanu k methanolu zmenšila 4,5krát. Konstanta zpětné reakce k−1 se od cyklohexanu k methanolu zvětšila 53krát a rovnovážná konstanta Keq se zmenšila 140krát. Předpokládá se, že jsou tyto změny způsobeny změnami polarity během aktivace reaktantů. Pravděpodobně jsou reakce ovlivňovány mírou polarity použitého rozpouštědla, která má vliv na změny dipólových momentů při přeměně z reaktantů přes meziprodukt k výsledným látkám. Cheletropní reakce nejsou výrazně ovlivňovány kyselostí či zásaditostí prostředí.
Výsledky tohoto výzkumu vedly k vytvoření následujících pravidel:
- Změna polarity rozpouštědla ovlivní rychlostní konstantu méně než rovnovážnou konstantu.
- Polarita ovlivňuje obě rychlostní konstanty opačně: k1 se s rostoucí polaritou zvyšuje, k−1 snižuje.
- Konstanta k−1 je polaritou prostředí ovlivňována více než k1.[8]
Adice karbenů na alkeny
[editovat | editovat zdroj]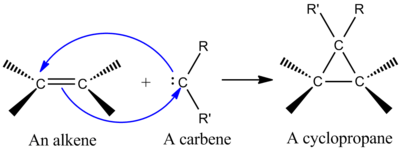
Jedním z nejvýznamnějších druhů cheletropní reakce je adice singletového karbenu na alken za vzniku cyklopropanu.[2] Karbeny jsou neutrální molekuly s dvouvazným uhlíkem se šesti elektrony ve valenční vrstvě, což z těchto látek dělá velmi reaktivní elektrofily a meziprodukty některých reakcí.[9] Singletový uhlík má prázdný orbital p a hybridní orbital sp2, v němž se nacházejí dva elektrony. Singletové uhlíky se stereospecificky adují na alkeny, stereochemie alkenu se ve vytvořeném produktu zachovává..[2] Mechanismus adice karbenu na alken odpovídá [2+1] cykloadici. Karbeny odvozené od chloroformu a bromoformu lze použít k adici CX2 na alken za vzniku dihalogencyklopropanu.[10]

Interakcí zaplněného orbitalu karbenu s π systémem alkenu vzniká čtyřelektronový systém upřednostňující nelineární přiblížení. Upřednostňováno je také spojení prázdného orbitalu p v karbenu s orbitalem π z molekuly alkenu.[2]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Cheletropic reaction na anglické Wikipedii.
- ↑ Chelotropic reaction IUPAC GoldBook
- ↑ a b c d e f Eric V. Anslyn and Dennis A. Dougherty Modern Physical Organic Chemistry University Science Books, 2006.
- ↑ Ian Fleming. Frontier Orbitals and Organic Chemistry Reactions. Wiley, 1976.
- ↑ a b D. Suarez; T. L. Sordo; J. A. Sordo. A Comparative Analysis of the Mechanisms of Cheletropic and Diels-Alder Reactions of 1,3-Dienes with Sulfur Dioxide: Kinetic and Thermodynamic Controls. The Journal of Organic Chemistry. 1995, s. 2848–2852.
- ↑ N. S. Isaacs; A. A. R. Laila. Rates of addition of sulphur dioxide to some 1,3-dienes. Tetrahedron Letters. 1976, s. 715–716.
- ↑ a b F. Monnat; P. Vogel; J. A. Sordo. Hetero-Diels-Alder and Cheletropic Additions of Sulfur Dioxide to 1,2-Dimethylidenecycloalkanes. Determination of Thermochemical and Kinetics Parameters for Reactions in Solution and Comparison with Estimates From Quantum Calculations. Helvetica Chimica Acta. 2002, s. 712–732.
- ↑ T. Fernandez; J. A. Sordo; F. Monnat; B. Deguin; P. Vogel. Sulfur Dioxide Promotes Its Hetero-Diels−Alder and Cheletropic Additions to 1,2-Dimethylidenecyclohexane. Journal of the American Chemical Society. 1998, s. 13276–13277.
- ↑ G. Desimoni; G. Faita; S. Garau; P. Righetti. Solvent effect in pericyclic reactions. X. The cheletropic reaction. Tetrahedron. 1996, s. 6241–6248.
- ↑ John McMurry Organic Chemistry, 6th Ed. Thomson, 2004.
- ↑ Robert B. Grossman The Art of Writing Reasonable Organic Reaction Mechanisms Springer, 2003.

![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][{\ce {SO2}}]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/daf1918f0d2b67189681e12fe5b4bb71b0920384)