Claisenův přesmyk
Claisenův přesmyk je chemická reakce sloužící k tvorbě vazeb uhlík-uhlík, při níž allylvinylether zahříváním iniciuje [3,3]-sigmatropní přesmyk za vzniku γ,δ-nenasycené karbonylové sloučeniny. Jedná se o první popsaný případ [3,3]-sigmatropního přesmyku.[1][2][3] Touto reakcí se zabývalo několik studií.[4][5][6][7]

Mechanismus
[editovat | editovat zdroj]Claisenův přesmyk je exotermní pericyklická reakce. Podle Woodwardových–Hoffmannových pravidel je suprafaciální. Kinetika odpovídá reakci prvního řádu, přeměna probíhá přes uspořádaný cyklický přechodný stav a je vnitromolekulární. Možnost mezimolekulárního mechanismu byla experimentálně vyloučena.[8][9] Na průběh Claisenova přesmyku mají významný vliv vlastnosti rozpouštědla, v polárních rozpouštědlech probíhá rychleji. Použití rozpouštědel vytvářejících vodíkové vazby vede k nejrychlejšímu průběhu reakce; například ve směsi vody a ethanolu bývají rychlostní konstanty desetkrát vyšší než v sulfolanu.[10][2] Trojvazné organohlinité sloučeniny, jako je trimethylhliník, také mohou urychlovat Claisenovy přesmyky.[11][12]
Varianty
[editovat | editovat zdroj]Aromatický Claisenův přesmyk
[editovat | editovat zdroj]Prvním popsaným Claisenovým přesmykem byl [3,3]-sigmatropní přesmyk allylfenyletheru na meziprodukt 1, který se rychle tautomeroval na ortho-substituovaný fenol:

Regioselektivitu tohoto přesmyku ovlivňuje substituce do polohy meta.[13][14] Pokud je například v poloze meta skupina snižující elektronovou hustotu (například bromid), tak řídí přesmyk do polohy ortho (71 % ortho produktu), zatímco skupina dodávající elektrony (jako je methoxy), jej řídí do polohy para (69 % para produktu). Přítomnost ortho-substituentů vede výhradně k para-substituovaným produktům.[15]

Pokud je na pozici ortho či para návázána aldehydová nebo karboxylová skupina, tak se působením allylového vedlejšího řetězce odštěpí, přičemž se uvolní oxid uhelnatý nebo oxid uhličitý.[16][17]
Bellusův–Claisenův přesmyk
[editovat | editovat zdroj]Bellusův–Claisenův přesmyk je reakce allyletherů, aminů a thioetherů s keteny za vzniku γ,δ-nenasycených esterů, amidů a thioesterů.[18][19][20] Objevil ji D. Bellus v roce 1979 a využil k získání meziproduktu při syntéze pyrethroidového insekticidu. Při této reakci se často používají halogenované keteny (R1, R2), protože jsou silnými elektrofily. K odstranění vzniklých α-halogenesterů, amidů a thioesterů lze použít řadu různých postupů.[21][22]

Eschenmoserův–Claisenův přesmyk
[editovat | editovat zdroj]Eschenmoserův–Claisenův přesmyk nastává při zahřívání allylalkoholů za přítomnosti dimethylacetalu N,N-dimethylacetamidu, produkty jsou γ,δ-nenasycené amidy. Tento postup vyvinul roku 1964 Albert Eschenmoser.[23][24] Eschenmoserův-Claisenův přesmyk se možné používá během totální syntézy morfinu.[25]
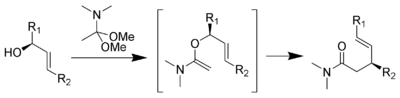
Mechanismus:[15]

Irelandův–Claisenův přesmyk
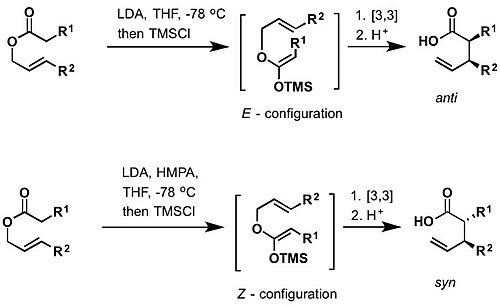
[editovat | editovat zdroj]Irelandův–Claisenův přesmyk je reakce allylkarboxylátu se silnou zásadou (například diisopropylamidem lithným) za vzniku γ,δ-nenasycené karboxylové kyseliny.[26][27][28] Meziproduktem je silylketenacetal vzniklý zachycením lithného enolátu chlortrimethylsilanem. Podobně jako výše popsaný Bellusův-Claisenův přesmyk probíhá při pokojové nebo vyšších teplotách. Z E--silylketenacetalů se tvoří anti a ze Z-reaktantů syn-produkty.[29] Bylo popsáno mnoho případů enantioselektivních Irelandových-Claisenových přesmyků, při kterých byly použity například chirální borité reaktanty jako chirální pomocníci.[30][31]
Johnsonův–Claisenův přesmyk
[editovat | editovat zdroj]Johnsonův–Claisenův přesmyk je reakce allylových alkoholů s orthoestery za vzniku γ,δ-nenascených esterů.[32] Jako katalyzátory se používají slabé kyseliny, jako je například kyselina propionová. Reakce obvykle probíhá za vysokých teplot (100 až 200 °C) a může trvat 10 až 120 hodin.[33]
Při zahřívání reakční směsi za účasti mikrovln a přítomnosti hexafluorokřemičitanu draselného nebo kyseliny propionové se vyznačuje mnohem rychlejším průběhem i lepší výtěžností.[34][35]

Mechanismus:[15]

Fotochemický Claisenův přesmyk
[editovat | editovat zdroj]Claisenův přesmyk aryletherů lze také provést jako fotochemickou reakci; přitom oproti ortho produktu tepelné reakce ([3,3]-přesmyku) vzniká též para produkt (výsledek [3,5]-přesmyku) i jiné izomery (například [1,3]- a [1,5]-produkty) a může dojít k odštěpení etherové skupiny a k tvorbě i alkyletherových produktů. Fotochemická varianta probíhá postupným mechanismem, kdy po radikálovém štěpení vazeb následuje tvorba nových vazeb, namísto pericyklického, což rozšiřuje spektrum použitelných substrátů a získatelných produktů.[36] [1,3] a [1,5] fotochemické Claisenovy přesmyky jsou podobné fotochemickým Friesovým přesmykům arylesterů a podobných acylových sloučenin.[37]
Claisenovy přesmyky heterocyklických sloučenin
[editovat | editovat zdroj]Aza přesmyky
[editovat | editovat zdroj]Iminiové ionty lze použít jako skupiny obsahující vazby pí.[38]

Oxidace chromem
[editovat | editovat zdroj]Sloučeniny chromu mohou oxidovat allylalkoholy na α,β-nenasycené ketony s násobnými vazbami na opačné straně molekuly oproti poloze původní alkoholové skupiny; přeměna probíhá soustředěným mechanismem, i když se zde objevují mechanistické rozdíly, protože atom chromu má volné orbitaly d, čímž umožňuje, aby reakce proběhla s méně omezenou geometrií.[39][40]
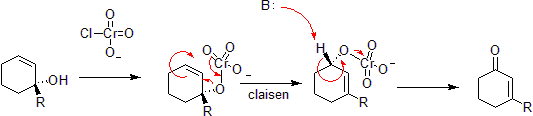
Chenova–Mappova reakce
[editovat | editovat zdroj]Chenova–Mappova reakce, také nazývaná jako [3,3]-fosforimidátový přesmyk nebo Staudingerova–Claisenova reakce, spočívá v použití fosfitu místo alkoholu a využívá výhody Staudingerovy reakce k jeho přeměně na imin. Následující Claisenův přesmyk je usnadněn tím, že dvojná vazba P=O je energeticky výhodnější než vazba P=N.[41]

Overmanův přesmyk
[editovat | editovat zdroj]Overmanův přesmyk je varianta Claisenova přesmyku používaná k přeměně allyltrichloracetimidátů na allyltrichloracetamidy.[42][43][44]

Overmanův přesmyk je možné použít na přípravu vicinoldiaminosloučenin z 1,2-vicinálních allyldiolů.
Zwitteriontový Claisenův přesmyk
[editovat | editovat zdroj]Na rozdíl od ostatních druhů Claisenova přesmyku, při nichž je nutné reakční směs zahřívat, probíhají zwitteriontové Claisenovy přesmyky za pokojové nebo i nižší teploty. Acylované amoniové kationty reagují velmi selektivně s Z-enoláty za mírných podmínek.[45][46]

V přírodních procesech
[editovat | editovat zdroj]Enzym chorismátmutáza (EC 5.4.99.5) katalyzuje Claisenův přesmyk chorismátu na prefenát, který je meziproduktem biosyntézy fenylalaninu a tyrosinu.

Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Claisen rearrangement na anglické Wikipedii.
- ↑ L. Claisen. Über Umlagerung von Phenol-allyläthern in C-Allyl-phenole. Chemische Berichte. 1912, s. 3157–3166. Dostupné online. doi:10.1002/cber.19120450348.
- ↑ a b L. Claisen; E. Tietze. Über den Mechanismus der Umlagerung der Phenol-allyläther. Chemische Berichte. 1925, s. 275. doi:10.1002/cber.19250580207.
- ↑ L. Claisen; E. Tietze. Über den Mechanismus der Umlagerung der Phenol-allyläther. (2. Mitteilung). Chemische Berichte. 1926, s. 2344. doi:10.1002/cber.19260590927.
- ↑ Hiersemann, M.; Nubbemeyer, U. (2007) The Claisen Rearrangement. Wiley-VCH. ISBN 3-527-30825-3
- ↑ S. J. Rhoads; N. R. Raulins. The Claisen and Cope Rearrangements. Organic Reactions. 1975, s. 1–252. ISBN 978-0471264187. doi:10.1002/0471264180.or022.01.
- ↑ F. E. Ziegler. The thermal, aliphatic Claisen rearrangement. Chemical Reviews. 1988, s. 1423–1452. doi:10.1021/cr00090a001.
- ↑ F. E. Wipf. Claisen Rearrangements. Chemical Reviews. 1991, s. 827–873. doi:10.1016/B978-0-08-052349-1.00140-2.
- ↑ C. D. Hurd; L. Schmerling. Observations on the Rearrangement of Allyl Aryl Ethers. Journal of the American Chemical Society. 1937, s. 107. doi:10.1021/ja01280a024.
- ↑ Francis A. Carey; Richard J. Sundberg. Advanced Organic Chemistry: Part A: Structure and Mechanisms. [s.l.]: Springer, 2007. Dostupné online. ISBN 978-0-387-44897-8. S. 934-935.
- ↑ L. Claisen. Über Umlagerung von Phenol-allyläthern in C-Allyl-phenole. Chemische Berichte. 1912, s. 3157–3166. Dostupné online. doi:10.1002/cber.19120450348.
- ↑ H. L. Goering; R. R. Jacobson. A Kinetic Study of the ortho-Claisen Rearrangement1. Journal of the American Chemical Society. 1958, s. 3277. doi:10.1021/ja01546a024.
- ↑ W. N. White; E. F. Wolfarth. The o-Claisen rearrangement. VIII. Solvent effects. The Journal of Organic Chemistry. 1970, s. 2196. doi:10.1021/jo00832a019.
- ↑ W. N. White; Carl Slater. The ortho-Claisen Rearrangement. V. The Products of Rearrangement of Allyl m-X-Phenyl Ethers. The Journal of Organic Chemistry. 1961, s. 3631–3638. doi:10.1021/jo01068a004.
- ↑ Fábio Gozzo; Sergio Antonio Fernandes; Denise Cristina Rodrigues; Marcos Nogueira Eberlin; Anita Jocelyne Marsaioli. Regioselectivity in Aromatic Claisen Rearrangements. The Journal of Organic Chemistry. 2003, s. 5493–5499. doi:10.1021/jo026385g. PMID 12839439.
- ↑ a b c László Kürti; Barbara Czakó. Strategic Applications Of Named Reactions In Organic Synthesis: Background And Detailed Mechanics: 250 Named Reactions. [s.l.]: Academic Press, 2005. Dostupné online. ISBN 978-0-12-429785-2. S. 934–935.
- ↑ Rodger Adams. Organic Reactions, Volume II. New York: John Wiley & Sons, 1944. Dostupné online. S. 11–12.
- ↑ L. Claisen; O. Eisleb. Über die Umlagerung von Phenolallyläthern in die isomeren Allylphenole. Justus Liebigs Annalen der Chemie. 1913, s. 90. Dostupné online. doi:10.1002/jlac.19134010103.
- ↑ R. Malherbe; D. Bellus. A New Type of Claisen Rearrangement Involving 1,3-Dipolar Intermediates. Preliminary communication. Helvetica Chimica Acta. 1978, s. 3096–3099. doi:10.1002/hlca.19780610836.
- ↑ R. Malherbe; G. Rist; D. Bellus. Reactions of haloketenes with allyl ethers and thioethers: A new type of Claisen rearrangement. The Journal of Organic Chemistry. 1983, s. 860–869. doi:10.1021/jo00154a023.
- ↑ J. Gonda. The Belluš–Claisen Rearrangement. Angewandte Chemie International Edition. 2004, s. 3516–3524. doi:10.1002/anie.200301718. PMID 15293240.
- ↑ E. Edstrom. An unexpected reversal in the stereochemistry of transannular cyclizations. A stereoselective synthesis of (±)-epilupinine. Tetrahedron Letters. 1991, s. 5709–5712. doi:10.1016/S0040-4039(00)93536-6.
- ↑ D. Bellus. Reactions of haloketenes with allyl ethers and thioethers: a new type of Claisen rearrangement. The Journal of Organic Chemistry. 1983, s. 860–869. doi:10.1016/S0040-4039(00)93536-6.
- ↑ A. E. Wick; D. Felix; K. Steen. CLAISEN'sche Umlagerungen bei Allyl- und Benzylalkoholen mit Hilfe von Acetalen des N, N-Dimethylacetamids. Vorläufige Mitteilung. Helvetica Chimica Acta. 1964, s. 2425–2429. doi:10.1002/hlca.19640470835.
- ↑ A. E. Wick; D. Felix; K. Gschwend-Steen. CLAISEN'sche Umlagerungen bei Allyl- und Benzylalkoholen mit 1-Dimethylamino-1-methoxy-äthen. Helvetica Chimica Acta. 1969, s. 1030–1042. doi:10.1002/hlca.19690520418.
- ↑ C. Guillou. Diastereoselective Total Synthesis of (±)-Codeine. Chemistry—A European Journal. 2008, s. 6606–6608. doi:10.1002/chem.200800744. PMID 18561354.
- ↑ R. E. Ireland; R. H. Mueller. Claisen rearrangement of allyl esters. Journal of the American Chemical Society. 1972, s. 5897. doi:10.1021/ja00771a062.
- ↑ R. E. Ireland; A. K. Willard. The stereoselective generation of ester enolates. Tetrahedron Letters. 1975, s. 3975–3978. doi:10.1016/S0040-4039(00)91213-9.
- ↑ R. E. Ireland; R. H. Mueller; A. K. Willard. The ester enolate Claisen rearrangement. Stereochemical control through stereoselective enolate formation. Journal of the American Chemical Society. 1976, s. 2868. doi:10.1021/ja00426a033.
- ↑ R. E. Ireland. Stereochemical control in the ester enolate Claisen rearrangement. The Journal of Organic Chemistry. 1991, s. 650–657. doi:10.1021/jo00002a030.
- ↑ E. Enders. Asymmetric [3,3]-sigmatropic rearrangements in organic synthesis. Tetrahedron: Asymmetry. 1996, s. 1847–1882. doi:10.1016/0957-4166(96)00220-0.
- ↑ E. Corey. Highly enantioselective and diastereoselective Ireland-Claisen rearrangement of achiral allylic esters. Journal of the American Chemical Society. 1991, s. 4026–4028. doi:10.1021/ja00010a074.
- ↑ William Summer Johnson; Lucius Werthemann; William R. Bartlett; Timothy J. Brocksom; Tsung-Tee Li; D. John Faulkner; Michael R. Petersen. Simple stereoselective version of the Claisen rearrangement leading to trans-trisubstituted olefinic bonds. Synthesis of squalene. Journal of the American Chemical Society. 1970-02-01, s. 741–743. ISSN 0002-7863. doi:10.1021/ja00706a074.
- ↑ R. A. Fernandes. The Orthoester Johnson–Claisen Rearrangement in the Synthesis of Bioactive Molecules, Natural Products, and Synthetic Intermediates – Recent Advances. European Journal of Organic Chemistry. 2013, s. 2833–2871. doi:10.1002/ejoc.201301033.
- ↑ R. S. Huber. Acceleration of the orthoester Claisen rearrangement by clay catalyzed microwave thermolysis: expeditious route to bicyclic lactones. The Journal of Organic Chemistry. 1992, s. 5778–5780. doi:10.1021/jo00047a041.
- ↑ A. Srikrishna. Application of microwave heating technique for rapid synthesis of γ,δ-unsaturated esters. Tetrahedron. 1995, s. 1809–1816. doi:10.1016/0040-4020(94)01058-8.
- ↑ Francisco Galindo. The photochemical rearrangement of aromatic ethers: A review of the Photo-Claisen reaction. Journal of Photochemistry and Photobiology C: Photochemistry Reviews. 2005, s. 123–138. doi:10.1016/j.jphotochemrev.2005.08.001.
- ↑ The IUPAC Compendium of Chemical Terminology: The Gold Book. Příprava vydání Victor Gold. 4. vyd. Research Triangle Park, NC: International Union of Pure and Applied Chemistry (IUPAC) Dostupné online. doi:10.1351/goldbook.p04614. (anglicky) DOI: 10.1351/goldbook.
- ↑ M. J. Kurth; O. H. W. Decker. Enantioselective preparation of 3-substituted 4-pentenoic acids via the Claisen rearrangement. The Journal of Organic Chemistry. 1985, s. 5769–5775. doi:10.1021/jo00350a067.
- ↑ W. G. Dauben; D. M. Michno. Direct oxidation of tertiary allylic alcohols. A simple and effective method for alkylative carbonyl transposition. The Journal of Organic Chemistry. 1977, s. 682. doi:10.1021/jo00424a023.
- ↑ (R)-(+)-3,4-Dimethylcyclohex-2-En-1-One. Organic Syntheses. 2005, s. 108. doi:10.15227/orgsyn.082.0108.
- ↑ B. Chen; A. Mapp. Thermal and catalyzed [3,3]-phosphorimidate rearrangements. Journal of the American Chemical Society. 2005, s. 6712–6718. doi:10.1021/ja050759g. PMID 15869293.
- ↑ L. E. Overman. Thermal and mercuric ion catalyzed [3,3]-sigmatropic rearrangement of allylic trichloroacetimidates. 1,3-Transposition of alcohol and amine functions. Journal of the American Chemical Society. 1974, s. 597–599. doi:10.1021/ja00809a054.
- ↑ L. E. Overman. A general method for the synthesis of amines by the rearrangement of allylic trichloroacetimidates. 1,3-Transposition of alcohol and amine functions. Journal of the American Chemical Society. 1976, s. 2901–2910. doi:10.1021/ja00426a038.
- ↑ Allylically Transposed Amines from Allylic Alcohols: 3,7-Dimethyl-1,6-Octadien-3-Amine. Organic Syntheses. 1978, s. 4. doi:10.15227/orgsyn.058.0004.
- ↑ C.-M. Yu; H.-S. Choi; J. Lee; W.-H. Jung; H.-J. Kim. Self-regulated molecular rearrangement: Diastereoselective zwitterionic aza-Claisen protocol. J. Chem. Soc., Perkin Trans. 1. 1996, s. 115–116. doi:10.1039/p19960000115.
- ↑ U. Nubbemeyer. 1,2-Asymmetric Induction in the Zwitterionic Claisen Rearrangement of Allylamines. The Journal of Organic Chemistry. 1995, s. 3773–3780. doi:10.1021/jo00117a032.
- ↑ B. Ganem. The Mechanism of the Claisen Rearrangement: Déjà Vu All over Again. Angewandte Chemie International Edition in English. 1996, s. 936–945. doi:10.1002/anie.199609361.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Claisenův přesmyk na Wikimedia Commons
Obrázky, zvuky či videa k tématu Claisenův přesmyk na Wikimedia Commons
