Sonogaširova reakce
Sonogaširova reakce je křížová párovací reakce koncového alkynu a aryl- či vinylhalogenidu používaná k tvorbě vazeb uhlík–uhlík. Používají se při ní katalyzátory založené na palladiu a měděné kokatalyzátory.[1]
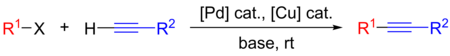 |
| Sonogaširova reakce |
|---|
- R1: aryl
- R2: aryl nebo vinyl
- X: I, Br, Cl nebo OTf
Používá se v řadě různých oblastí, protože je dobrým způsobem vytváření nových vazeb uhlík–uhlík. Lze ji provést za mírných podmínek, jako jsou pokojová teplota, vodné prostředí a slabší zásady, díky čemuž může být Sonogaširova reakce zapojena do syntéz složitých molekul, jako jsou léky, přírodní látky a nanomateriály.[1]
Jako příklady lze uvést syntézy tazarotenu,[2] sloužícího k léčbě lupénky a akné, a SIB-1508Y, známého také jako altiniklin,[3] agonisty nikotinového acetylcholinového receptoru.
Historie
[editovat | editovat zdroj]Alkynylace arylhalogenidů pomocí aromatických acetylenů byla popsána ve třech navzájem nezávislých pracích z roku 1975, jejichž autory byli L. Cassar,[4] H. A. Dieck a Richard F. Heck[5] a také Kenkiči Sonogašira, J. Tohda a N. Hagihara.[6]
Všechny výše uvedené reakce využívají palladiové katalyzátory, ovšem reakce provedené Cassarem a Heckem zahrnují pouze palladium a vyžadují tvrdé reakční podmínky (například vysoké teploty). Přidání měděného kokatalyzátoru ke komplexům palladia u Sonogaširova postupu umožnilo reakce za mírných podmínek a s velmi dobrými výtěžnostmi. Rychlý rozvoj Pd/Cu systémů umožnil mnoho syntetických využití, zatímco Cassarova a Heckova varianta byly opuštěny[7] a využitelnost reakce potvrzená dalším výzkumem a neustále rozšiřovaná a zapojovaná do syntéz řady sloučenin se syntetickým, medicinálním nebo průmyslovým využitím.[7] Je podrobněji popsána v řadě dalších prací, podobně jako Suzukiova a Heckova reakce.[8]
Sonogaširova reakce se stala natolik známou, že se často všechny reakce využívající k přeměně alkynů organopalladiové katalyzátory označují jako varianty „Sonogaširovy reakce“, přestože se neprovádějí za podmínek odpovídajících Sonogaširově reakci.[7]
Mechanismus
[editovat | editovat zdroj]
Reakční mechanismus není plně známý, navržení podoba ovšem zahrnuje palladiový cyklus odpovídající „klasickému“ mechanismu křížového párování; ale také cyklus mědi.[9]
Cyklus palladia
[editovat | editovat zdroj]Palladiový prekatalyzátor se aktivuje za vzniku reaktivní sloučeniny Pd0 (A). Přesné sloučeniny tohoto katalyzátoru závisí na podmínkách reakce. S jednoduchými fosfiny, jako jsou PPh3 (n=2), a u fosfinů s objemnými substituenty, například P(o-Tol)3, se tvoří monoligované meziprodukty (n=1).[10]
Výsledky některých studií naznačují tvorbu aniontových sloučenin, [L2Pd0Cl]−, které by mohly za přítomnosti halogenidů vlastními katalyzátory.[11]
- Aktivní Pd0 katalyzátor se zapojuje do oxidačně adiční reakce s aryl- nebo vinylhalogenidovým substrátem za tvorby sloučeniny PdII (B); jeho struktura závisí na použitých ligandech. Tento krok je pravděpodobně tím, který určuje rychlost reakce.
- Komplex B reaguje s acetylidem mědi, komplexem F, přičemž transmetalací vzniká komplex C a obnovuje se měďnatý katalyzátor.
- Struktura komplexu C závisí na vlastnostech ligandu. Pro průběh redukční eliminace je nutné, aby strukturní prvky substrátu byly blízko sebe, například vzájemně v poloze cis. Při redukční eliminaci se z komplexu oddělí tolan a obnoví se aktivní katalyzátor.
Cyklus mědi
[editovat | editovat zdroj]- Cyklus mědi není celý dobře popsán. Předpokládá se, že přítomnost zásady vede k tvorbě π-alkynového komplexu E. Tím se zvyšuje kyselost koncového protonu a po deprotonaci vzniká komplex acetylidu (F).
- Acetylid F vstoupí do transmetalační reakce s meziproduktem B.
Mechanismus Sonogaširovy varianty bez použití mědi
[editovat | editovat zdroj]I když představuje výhodu, vzhledem k vylepšení účinnosti reakce, tak použití solí mědi u Sonogaširovy reakce má několik nedostatků, jako jsou použití reaktantů nešetrných k životnímu prostředí, tvorba nežádoucích vedlejších produktů Glaserovým párováním a nutnost naprosté nepřítomnosti kyslíku v reakční směsi. Byly tak vyvinuty i bezměďové varianty Sonogaširovy reakce. Spolu s vývinem nových reakčních podmínek byly také provedeny experimentální a výpočetní studie zaměřené na mechanismus reakce.[12]
Přesný mechanismus reakce bez použití mědi dlouho nebyl znám.[7] V roce 2018 zjistili J. Košmrlj et al., že reakce má dva propojené Pd0/PdII katalytické cykly.[13][14]
![Mechanismus Sonogaširovy reakce bez použití mědi[13][14]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/90/Cu-free-mechanism.png/600px-Cu-free-mechanism.png) |
| Mechanismus Sonogaširovy reakce bez použití mědi[13][14] |
|---|
- Podobně jako u původního mechanismu začíná cyklus Pd0 oxidační adicí arylhalogenidu nebo aryltriflátu na Pd0 katalyzátor za vzniku komplexu B a aktivace substrátu.
- Ve druhém cyklu, řízeném PdII, se aktivuje acetylen. U fenylacetylenu bylo zjištěno, že za mírných podmínek vytváří s palladiem monoacetylidový komplex D a také bisacetylidový komplex F.
- Oba aktivované komplexy B a F se zapojí do transmetalace, čímž se vytvoří komplex C a obnoví D.
- Tyto produkty redukční eliminace, disubstituovaný alkyn a obnovený Pd0 katalyzátor, uzavírají Pd0 katalytický cyklus.
Ukázalo se, že jako ligandy L mohou vedle fosfinů posloužit i aminy.[13][14][15][16]
Podmínky reakce
[editovat | editovat zdroj]Sonogaširova reakce se většinou provádí za mírných podmínek.[17] Křížové párování za pokojové teploty vyžaduje přítomnost zásady, obvykle aminu, jako je například diethylamin,[6] který také funguje jako rozpouštědlo. Zásadité reakční prostředí neutralizuje halogenovodíkový vedlejší produkt, takže se jako rozpouštědla často používají aminy, například triethylamin a diethylamin, lze je však nahradit dimethylformamidem (DMF) nebo diethyletherem. Ojediněle se používají i jiné zásady, jako uhličitan draselný nebo uhličitan cesný. U Sonogaširových reakcí je obvykle nutná nepřítomnost vzduchu, protože jsou komplexy Pd0 na vzduchu nestálé a kyslík způsobuje tvoru homopárovaných acetylenů.
Byly však vyvinuty i organopalladiové katalyzátory stálé na vzduchu, které umožnily provedení těchto reakcí i za přítomnosti kyslíku. Byla popsána vysoce regioselektivní reakce 1,2,3-trihalogenarenů s vysokouu výtěžností za běžných podmínek.[18]
Katalyzátory
[editovat | editovat zdroj]Obvykle jsou pro tuto reakci potřeba dva katalyzátory: komplex Pd0 a měďný halogenid. Palladiové katalyzátory mohou obsahovat fosfinové ligandy, jako jsou [Pd(PPh3)4]. Další častý zdroj palladia představuje [Pd(PPh3)2Cl2}, jsou také používány komplexy obsahující bidentátní fosfiny, například [Pd(dppe)Cl2], [Pd(dppp)Cl2] a [Pd(dppf)Cl2].[9] Nevýhodou těchto katalyzátorů je potřeba velkých množství palladia (až 5 mol %), i měďných kokatalyzátorů.[9]
Palladnaté komplexy jsou ve skutečnosti prekatalyzátory, protože musí být redukovány na Pd0, než se zapojí do katalýzy. Obvykle jsou stálejší než komplexy Pd0 a lze je dlouhodobě skladovat za běžných laboratorních podmínek.[19] PdII katalyzátory jsou na Pd0 redukovány aminem, fosfinem nebo i jiným reaktantem.[20] K tvorbě Pd0 může vést například reakce trifenylfosfinu s [Pd(PPh3)2Cl2] za vzniku trifenylfosfinoxidu.
Měďné soli, například jodid měďný (CuI), reagují s koncovými alkyny za tvorby acetylidu měďného, který, slouží jako aktivovaná molekula. Měďné sloučeniny slouží jako kokatalyzátory.[7]
Arylhalogenidy a pseudohalogenidy
[editovat | editovat zdroj]Výběr konkrétního arylhalogenidového nebo pseudohalogenidového substrátu (s sp2 uhlíkem) má velký vliv na reaktivitu Sonogaširova katalytického systému. Reaktivita halogenidů je největší u jodu a vinylhalogenidy jsou reaktivnější než odpovídající arylhalogenidy.
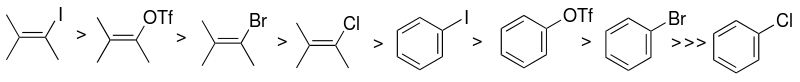
Místo arylhalogenidů mohou být také použity aryltrifláty.
Arendiazoniové prekurzory
[editovat | editovat zdroj]Arendiazoniové lze použít jako náhradu arylhalogenidů. Chlorid zlatný byl použit jako kokatalyzátor společně s chloridem palladnatým při reakcích arendiazoniových solí s koncovými alkyny; bis-2,6-diisopropylfenyldihydroimidazoliumchlorid (5 mol %) vytvářel NHC–Pd komplex a jako zásada sloužil 2,6-di-terc-butyl-4-methylpyridin (DBMP) v acetonitrilu; reakce probíhala za pokojové teploty.[21]
Při tomto druhu párovací reakce se používají na přípravu diazoniových solí aniliny, jež se poté reakcí s fenylacetylenem přemění na alkyny.
Alkyny
[editovat | editovat zdroj]Do Sonogaširových reakcí lze zapojit mnoho různých aromatických alkynů tak, aby vznikaly disubstituované produkty s dobrými výtěžnostmi. Alifatické alkyny bývají méně reaktivní.
Zásady
[editovat | editovat zdroj]Vzhledem k nezastupitelnému významu zásad musí být aminy použity v přebytku nebbo jako rozpouštědlo. Zjistilo se, že sekundární aminy, jako například piperidin, morfolin a diisopropylamin mohou účinně a vratně reagovat s okomplexy trans-RPdX(PPh3)2, za nahrazení jednoho PPh3 ligandu. Rovnovážná konstanta této reakce závisí na R, X, síle zásady a sterických efektech vyvolávaných aminem.[22] Vyskytuje se zde rovnováha mezi aminovými a alkynovými ligandy a z tohoto důvodu se ligand přidává v přebytku, aby se navazovaly hlavně aminové skupiny.
Varianty
[editovat | editovat zdroj]Bezměďná Sonogaširova reakce
[editovat | editovat zdroj]I když měďné kokatalyzátory navyšují reaktivitu, tak jejich přítomnost může způsobit dimerizaci alkynů, čímž dochází ke Glaserovu párování, kdy se oxidací vytváří produkty homopárování derivátů acetylenu. Při provádění Sonogaširových reakcí se sloučeninami mědi je tak k zabránění těmto dimerizacím nutná nepřítomnost vzduchu. Byly tak vyvinuty bezměďné varianty Sonogaširova párování.[19][23] Existují i jiné případy, kdy je třeba se vyhnout použití mědi, například, pokud se používají substráty, jež se mohou vázat na měď, jako jsou porfyriny.[9]
Obrácené Sonogaširovo párování
[editovat | editovat zdroj]Při obráceném Sonogaširově párování reaguje arylová nebo vinylová sloučenina s alkynylhalogenidem.[24]
Varianty katalyzátorů
[editovat | editovat zdroj]Stříbrné kokatalyzátory
[editovat | editovat zdroj]V některých případech lze jako kokatalyzátor místo CuI použít stechiometrické množství oxidu stříbrného.[9]
Niklové katalyzátory
[editovat | editovat zdroj]Byla vyvinuta Sonogaširova reakce katalyzovaná niklem, při níž lze použít neaktivované alkylhalogenidy bez přítomnosti palladia, i když je stále nutný měďný kokatalyzátor.[25]
Také bylo popsáno použití zlata (s oxidem ceričitým) jako heterogenního katalyzátoru, a to při párování fenylacetylenu s jodbenzenem.[26][27]
V tomto případě probíhá katalýza na nanočásticích zlata,[27][28] kde jako aktivní místo slouží Au0.[29] Selektivita vzhledem k požadovanému produktu může být navýšena mimo jiné pomocí oxidu ceričitého (CeO2) nebo oxidu lanthanitého (La2O3).[29]
Sonogaširovy reakce katalyzované železem se ukázaly jako poměrně levné a netoxické alternativy k palladiovým variantám. Jako katalyzátor zde funguje FeCl3 a jako zásada Cs2CO3, takže se jedná o mechanismus neobsahující palladium ani měď.[30]
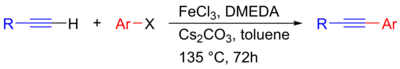 |
| Bezpalladiová Sonogaširova reakce katalyzovaná železem[30] |
|---|
Zatímco se bezměďný mechanismus ukázal jako využitelný, tak pokusy o zapojení jiných přechodných kovů uvedených výše jako méně nákladných náhrad palladiových katalyzátorů se ukázaly jako nevyužitelné, protože docházelo ke znečišťování katalyzátorů malými množstvími palladia, což vedlo k zjištění, že tyto postupy jsou obtížně proveditelné, pokud ne nemožné.[31]
Bylo zjištěno, že i organické a anorganické výchozí materiály mohou obsahovat dostatek palladia na to, aby došlo k párovacím reakcím.[32]
Katalýza pomocí palladia a zlata
[editovat | editovat zdroj]Byly popsány velmi účinné Sonogaširovy reakce katalyzované zlatem a palladiem u elektronově i strukturně rozmanité skupiny aryl- a heteroarylhalogenidů.[33]
Ortogonální reaktivita této dvojice kovů vykazuje vysokou selektivitu a toleranci mnoha různých funkčních skupin. Při mechanistické studii bylo zjištěno, že v transmetalačním kroku se tvoří meziprodukt v podobě acetylidu zlata, který vstupuje do katalytického cyklu palladia.
Dendrimerní komplexy palladia
[editovat | editovat zdroj]Potíže s obnovováním často nákladných katalyzátorů představují vážný nedostatek pro průmyslové využití homogenně katalyzovaných Sonogaširových reakcí.[9] Pomocí metalodendrimerů spojují výhody homogenních a heterogenních katalyzátorů, jelikož jsou rozpustné a mají dobře určené molekulární struktury, a tak mohou být obnovovány vysrážením, ultrafiltrací nebo ultracentrifugací.[34]
Použito bylo několik generací bidentátních fosfinových palladnatých polyaminodendritických katalyzátorů rozpuštěných v triethylaminu, které zprostředkovávaly párování aryljodidů a arylbromidů při 25 až 120 °C; u arylchloridů reakce rovněž probíhaly, ovšem výtěžnosti byly nízké.[35]
Dendrimerní katalyzátory obvykle lze obnovit jednoduchým srážením a následnou filtrací, poté mohou být použity ještě pětkrát, než se v důsledku rozkladu dendrimeru sníží jejich aktivita. Tyto dendrimery mají záporný dendritický efekt; s nárůstem generace dendrimeru se jeho účinnost snižuje. Níže zobrazený obnovitelný polymerní fosfinový ligand se přippravuje metatezní polymerací s otevíráním kruhu norbornenové sloučeniny; použit byl při mědí kokatalyzované Sonogaširově reakci methylpiodobenzátu a fenylacetylenu za použití Pd(dba)2*CHCl3 jako zdroje palladia.[36]
I přes obnovu filtrací se aktivita polymerního katalyzátoru po každém použití snižuje o 4 až 8 %.
Dusíkaté ligandy
[editovat | editovat zdroj]Pyridiny a pyrimidiny dobře komplexují palladium a byly zapojeny do přípravy katalyzátorů pro Sonogaširovy reakce. Dipyrimidylpalladiový komplex znázorněný níže byl použit na bezměďná párování jod-, brom- a chlorbenzenů s fenylacetylenem za použití N-butylaminu v tetrahydrofuranu při 65 °C. Struktura tohoto komplexu byla popsána pomocí rentgenové analýzy.[37]
Později bylo získáno dipyridylpalladium a použito při bezměďných Sonogaširových párováních aryljodidů a arylbromideů v N-methylpyrrolidinonu (NMP) za použití tetra-n-butylamoniumacetátu (TBAA) jako zásady za pokojové teploty. Stejný komplex byl také použit k párování aryljodidů a arylbromidů v refluxované vodě za přítomnosti vzduchu, kde byl zásadou pyrrolidin s přídavkem TBAB,[38] i když bylo vyšší účinnosti dosaženo, když byl jako rozpouštědlo použit N-methylpyrrolidinon.

Komplexy palladia a N-heterocyklických karbenů
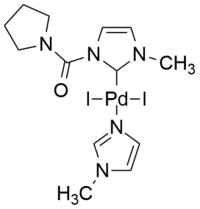
[editovat | editovat zdroj]N-heterocyklické karbeny jsou jednou z nejvýznamnějších skupin ligandů při katalýze přechodnými kovy. Úspěšnost použití běžných N-heterocyklických karbenů se přičítá tomu, že jde o lepší σ-donory než jsou fosfiny, tato vlastnost je ještě výraznější u některých neobvyklých variant. Jako ligandy v komplexech palladia N-heterocyklické karbeny výrazně podporují stabilizaci a aktivaci prekatalyzátorů a tak se využívají v řadě organokovových homogenních katalýz, například Sonogaširových párováních.[9][40][41]
 |
 |
| Příklad palladnatého komplexu s běžným N-heterocyklickým ligandem[42] | iPEPPSI katalyzátor bezměďné Sonogaširovy reakce ve vodě[40] |
Jako příklad neobvyklých N-heterocyklických karbenů lze uvést skupinu mezoiontových 1,2,3-triazol-5-ylidenů. Dobrými kationtovými palladiovými katalyzátory jsou například sloučeniny odvozené od PEPPSI, například iPEPPSI, jež katalyzuje bezměďné Sonogaširovy reakce, při kterých je jako jediné rozpouštědlo použita voda, za přítomnosti vzduchu, přičemž, kromě mědi nejsou přítomny ani aminy, fosfiny nebo jiné přídatné látky.[40]
Syntetická využití
[editovat | editovat zdroj]Sonogaširovy reakce jsou zahrnuty do mnoha syntetických postupů:
Alkynylace
[editovat | editovat zdroj]Párování koncových alkynů s aromatickými sloučeninami je jedním z prvních využití Sonogaširových reakcí. Seznam všech takových využití by byl velmi dlouhý. Níže je zobrazeno využití tohoto postupu pro párování jodovaného fenylalaninu s D-biotinem pomocí in situ připraveného Pd0 katalyzátoru,které posloužilo k přípravě alkynovaného derivátu fenylalaninu pro bioanalytické účely.[43]
Také byly popsány případy, kdy byly obě reagující sloučeniny navázány na allylové pryskyřice, kde Pd0 katalyzátor zlepšoval účinnost štěpení substrátů za následného průběhu Sonogaširovy reakce.[44]

Syntéza přírodních látek
[editovat | editovat zdroj]Mnoho metabolitů obsahuje alkynové nebo enynové skupiny, a tak se při syntézách řady z nich používají Sonogaširovy reakce.[45]
Párováním aryljodidu s arylacetylenem v podobě reakce jodovaného alkoholu s tris(isopropyl)silylacetylenem vzniká alkynový meziprodukt totální syntézy benzindenoazepinového alkaloidu bulgaraminu.
Jsou známy i další případy použití aryljodidů v Sonogaširových reakcích sloužících k přípravě meziproduktů, ze kterých po cyklizaci vznikají například benzylisochinolinové[46] nebo indolové alkaloidy.[47]
Jako příklad lze uvést přípravu benzylisochinolinových alkaloidů (+)-(S)-laudanosinu a (–)-(S)-xylopininu. Součástí jejich syntéz jsou Sonogaširovy reakce, které vytváří uhlíkové řetězce těchto molekul.[46]

Enyny a endiyny
[editovat | editovat zdroj]1,3-enyny jsou významnými funkčními skupinami v biologicky aktivních sloučeninách. Lze je připravit z vinylových sloučenin a koncových alkynů stereospecifickými procesy zachovávajícími konfiguraci, jako je Sonogaširova reakce. Nejreaktivnějšími vinylhalogenidy při Pd0 oxidačních adicích jsou vinyljodidy, ty se také používají nejčastěji, jelikož obvykle vyžadují mírnější reakční podmínky. Jako příklady je možné uvést:
- Párování 2-jod-prop-2-enolů s acetyleny[48]
- Příprava alk-2-ynylbuta-1,3-dienů párováním dijodidů s fenylacetylenem[49]

Výroba léčiv
[editovat | editovat zdroj]Díky své všestrannosti jsou Sonogaširovy reakce často zapojované do výroby mnoha sloučenin. Jedním z nich je syntéza SIB-1508Y, látky častěji nazývané altiniklin. Altiniklin je agonista nikotinového acetylcholinového receptoru s potenciálem léčit Parkinsonovu a Alzheimerovu nemoc, Touretteův syndrom, schizofrenii a ADHD.[3][50][51][52]

Sonogaširovu reakci lze použít na přípravu imidazopyridinů.

Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Sonogaširova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Sonogaširova reakce na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Sonogashira coupling na anglické Wikipedii.
- ↑ a b K. Sonogashira. Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides. Journal of Organometallic Chemistry. 2002, s. 46–49. DOI 10.1016/s0022-328x(02)01158-0.
- ↑ A. O. King; N. Yasuda. A Practical and Efficient Process for the Preparation of Tazarotene. Organic Process Research & Development. 2005, s. 646–650. DOI 10.1021/op050080x.
- ↑ a b c A. O. King; N. Yasuda. Palladium-Catalyzed Cross-Coupling Reactions in the Synthesis of Pharmaceuticals Organometallics in Process Chemistry. Topics in Organometallic Chemistry. 2004, s. 205–245. ISBN 978-3-540-01603-8. DOI 10.1007/b94551.
- ↑ L. Cassar. Synthesis of aryl- and vinyl-substituted acetylene derivatives by the use of nickel and palladium complexes. Journal of Organometallic Chemistry. 1975, s. 253–257. DOI 10.1016/S0022-328X(00)94048-8.
- ↑ H. A. Dieck; R. F. Heck. Palladium catalyzed synthesis of aryl, heterocyclic and vinylic acetylene derivatives. Journal of Organometallic Chemistry. 1975, s. 259–263. DOI 10.1016/S0022-328X(00)94049-X.
- ↑ a b K. Sonogashira; Y. Tohda; N. Hagihara. A convenient synthesis of acetylenes: catalytic substitutions of acetylenic hydrogen with bromoalkenes, iodoarenes and bromopyridines. Tetrahedron Letters. 1975, s. 4467–4470. DOI 10.1016/s0040-4039(00)91094-3.
- ↑ a b c d e f R. Chinchilla; C. Nájera. Recent advances in Sonogashira reactions. Chemical Society Reviews. 2011, s. 5084–5121. DOI 10.1039/c1cs15071e. PMID 21655588.
- ↑ C. C. C. Seechurn; M. O. Kitching; T. J. Colacot; V. Snieckus. alladium-Catalyzed Cross-Coupling: A Historical Contextual Perspective to the 2010 Nobel Prize. Angewandte Chemie International Edition. 2012, s. 5062–5085. DOI 10.1002/anie.201107017. PMID 22573393.
- ↑ a b c d e f g h R. Chinchilla; C. Nájera. The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry. Chemical Reviews. 2007, s. 874–922. DOI 10.1021/cr050992x. PMID 17305399.
- ↑ J. P. Stambuli; M. Buhl; J. F. Hartwig. Synthesis, Characterization, and Reactivity of Monomeric, Arylpalladium Halide Complexes with a Hindered Phosphine as the Only Dative Ligand. Journal of the American Chemical Society. 2002, s. 9346–9347. DOI 10.1021/ja0264394. PMID 12167009.
- ↑ C. Amatore; A. Jutand. Anionic Pd(0) and Pd(II) Intermediates in Palladium-Catalyzed Heck and Cross-Coupling Reactions. Accounts of Chemical Research. 2000, s. 314–321. DOI 10.1021/ar980063a.
- ↑ A. Soheili; J. Albaneze-Walke; J. A. Murry; P. G. Dormer; D. L. Hughes. Efficient and General Protocol for the Copper-Free Sonogashira Coupling of Aryl Bromides at Room Temp. Organic Letters. 2003, s. 4191–4194. DOI 10.1021/ol035632f.
- ↑ a b c d GAZVODA, M.; VIRANT, M.; PINTER, B.; KOŠMRLJ, J. Mechanism of copper-free Sonogashira reaction operates through palladium-palladium transmetallation. Nature Communications. 2018. DOI 10.1038/s41467-018-07081-5. PMID 30446654.
- ↑ a b c d Šablona:Cite thesis
- ↑ A. Tougerti; A. Negri; A. Jutand. Mechanism of the Copper-Free Palladium-Catalyzed Sonogashira Reactions: Multiple Role of Amines. Chemistry—A European Journal. 2007, s. 666–676. DOI 10.1002/chem.200600574. PMID 16991183.
- ↑ H. Plenio. Catalysts for the Sonogashira Coupling—The Crownless Again Shall Be King. Angewandte Chemie International Edition. 2008, s. 6954–6956. DOI 10.1002/anie.200802270. PMID 18683173.
- ↑ Kohnen, A. L; DANHEISER, R. L.; DENMARK S. E.; LIU X. Synthesis of Terminal 1,3-Diynes Via Sonogashira Coupling of Vinylidene Chloride Followed by Elimination. Preparation of 1,3-Decadiyne. Organic Syntheses. 2007, s. 77–87. DOI 10.15227/orgsyn.084.0077. PMID 20628544.
- ↑ AL-ZOUBI, Raed. Palladium-catalyzed highly regioselective mono and double Sonogashira cross-coupling reactions of 5-substituted-1,2,3-triiodobenzene under ambient conditions†. RSC Advances. 16 April 2020, s. 16376. Dostupné online [cit. 21 July 2020]. DOI 10.1039/d0ra01569e.
- ↑ a b Bohm, V. P. W.; HERRMANN, W. A. A Copper-Free Procedure for the Palladium-Catalyzed Sonogashira Reaction of Aryl Bromides with Terminal Alkynes at Room Temperature. European Journal of Organic Chemistry. 2000, s. 3679–3681. DOI 10.1002/1099-0690(200011)2000:22<3679::aid-ejoc3679>3.0.co;2-x.
- ↑ Yin, L.; LIEBSCHER, J. Carbon-Carbon Coupling Reactions Catalyzed by Heterogeneous Palladium Catalysts. Chemical Reviews. 2006, s. 133–173. DOI 10.1021/cr0505674. PMID 17212474.
- ↑ Panda B., Sarkar T. K. Gold and palladium combined for the Sonogashira-type cross-coupling of arenediazonium salts. Chemical Communications. 2010, s. 3131–3133. DOI 10.1039/c001277g.
- ↑ A. Jutand; S. Négri; A. Principaud. Formation of ArPdXL(amine) Complexes by Substitution of One Phosphane Ligand by an Amine in trans-ArPdX(PPh3)2 Complexes. European Journal of Inorganic Chemistry. 2005, s. 631–635. DOI 10.1002/chem.200600574. PMID 10.1002/ejic.200400413.
- ↑ D. Mery; K. Heuze; D. Astruc. A very efficient, copper-free palladium catalyst for the Sonogashira reaction with aryl halides. Chem. Commun.. 2003, s. 1934–1935. DOI 10.1002/chem.200600574. PMID 10.1039/B305391C.
- ↑ A. Dudnik; V. Gevorgyan. Formal Inverse Sonogashira Reaction: Direct Alkynylation of Arenes and Heterocycles with Alkynyl Halides. Angewandte Chemie International Edition. 2010, s. 2096–2098. DOI 10.1002/anie.200906755. PMID 20191647.
- ↑ O. Vechorkin; D. Barmaz; V. Proust; X. Hu. Ni-Catalyzed Sonogashira Coupling of Nonactivated Alkyl Halides: Orthogonal Functionalization of Alkyl Iodides, Bromides, and Chlorides. Journal of the American Chemical Society. 2009, s. 12078–12079. DOI 10.1021/ja906040t. PMID 19670863.
- ↑ C. Gonzalez-Arallano; A. Abad; A. Corma; H. Garcia; M. Iglesias; F. Sanchez. Catalysis by Gold(I) and Gold(III): A Parallelism between Homo- and Heterogeneous Catalysts for Copper-Free Sonogashira Cross-Coupling Reactions. Angewandte Chemie International Edition. 2007, s. 1536–1538. DOI 10.1002/anie.200604746. PMID 17226890.
- ↑ a b A. Corma; R. Juarez; M. Boronat; F. Sanchez; M. Iglesias; H. Garcia. Gold catalyzes the Sonogashira coupling reaction without the requirement of palladium impurities. Chem. Commun.. 2011, s. 1446–1448. DOI 10.1039/C0CC04564K. PMID 21183985.
- ↑ G. Kyriakou; S. K. Beaumont; S. M. Humphrey; C. Antonetti; R. M. Lambert. Sonogashira Coupling Catalyzed by Gold Nanoparticles: Does Homogeneous or Heterogeneous Catalysis Dominate?. ChemCatChem. 2010, s. 1444–1449. DOI 10.1002/cctc.201000154.
- ↑ a b S. K. Beaumont; G. Kyriakou; R. M. Lambert. Identity of the active site in gold nanoparticle-catalyzed Sonogashira coupling of phenylacetylene and iodobenzene. Journal of the American Chemical Society. 2010, s. 12246–12248. Dostupné online. DOI 10.1021/ja1063179.
- ↑ a b M. Carril; A. Correa; C. Bolm. Iron-Catalyzed Sonogashira Reaction. Angewandte Chemie. 2008, s. 4940–4943. DOI 10.1002/ange.200801539.
- ↑ Thorsten Lauterbach; Madeleine Livendahl; Antonio Rosellon; Pablo Espinet; Antonio M. Echavarren. Unlikeliness of Pd-Free Gold(I)-Catalyzed Sonogashira Coupling Reactions. Organic Letters. 2010, s. 3006–3009. DOI 10.1021/ol101012n.
- ↑ L. G. Tolnai; Z. S. Gonda; Z. Novák. Dramatic Impact of ppb Levels of Palladium on the "Copper-Catalyzed" Sonogashira Coupling. Chemistry—A European Journal. 2010, s. 11822–11826. DOI 10.1002/chem.201001880.
- ↑ B. Panda; T. K. Sarkar. Gold and Palladium Combined for the Sonogashira Coupling of Aryl and Heteroaryl Halides. Synthesis. 2013, s. 817–829. DOI 10.1055/s-0032-1318119.
- ↑ Didier Astruc; Karine Heuzé; Sylvain Gatard; Denise Méry; Sylvain Nlate; Lauriane Plault. Metallodendritic Catalysis for Redox and Carbon—Carbon Bond Formation Reactions: A Step towards Green Chemistry. Advanced Synthesis & Catalysis. 2005, s. 329–338. DOI 10.1002/adsc.200404247.
- ↑ Karine Heuzé; Denise Méry; Dominik Gauss; Didier Astruc. Copper-free, recoverable dendritic Pd catalysts for the Sonogashira reaction. Chem. Commun.. 2003, s. 2274–2275. DOI 10.1039/B307116M.
- ↑ Yun-Chin Yang; Tien-Yau Luh. Polymeric Phosphine Ligand from Ring-Opening Metathesis Polymerization of a Norbornene Derivative. Applications in the Heck, Sonogashira, and Negishi Reactions. The Journal of Organic Chemistry. 2003, s. 9870–9873. DOI 10.1021/jo035318z. PMID 14656129.
- ↑ Michael R. Buchmeiser; Thomas Schareina; Rhett Kempe; Klaus Wurst. Bis(pyrimidine)-based palladium catalysts: Synthesis, X-ray structure and applications in Heck–, Suzuki–, Sonogashira–Hagihara couplings and amination reactions. Journal of Organometallic Chemistry. 2001, s. 39–46. DOI 10.1016/S0022-328X(01)01083-X.
- ↑ J. Gil-Moltó; S. Karström; C. Nájera. Di(2-pyridyl)methylamine–palladium dichloride complex covalently anchored to a styrene-maleic anhydride co-polymer as recoverable catalyst for C–C cross-coupling reactions in water. Tetrahedron. 2005, s. 12168–12176. DOI 10.1016/j.tet.2005.08.122.
- ↑ J. Gil-Moltó; C. Nájera. Palladium(II) Chloride and a (Dipyridin-2-ylmethyl)amine-DerivedPalladium(II) Chloride Complex as Highly Efficient Catalysts for the Synthesis of Alkynes in Water or in NMP and of Diynes in the Absence of Reoxidant. European Journal of Organic Chemistry. 2005, s. 4073–4081. DOI 10.1002/ejoc.200500319.
- ↑ a b c M. Gazvoda; M. Virant; A. Pevec; D. Urankar; A. Bolje; M. Kočevar; J. Košmrlj. A mesoionic bis(Py-tzNHC) palladium(II) complex catalyses green Sonogashira reaction through an unprecedented mechanism. Chem. Commun.. 2016, s. 1571–1574. DOI 10.1039/c5cc08717a. PMID 26575368.
- ↑ Cathleen M. Crudden; Daryl P. Allen. Stability and reactivity of N-heterocyclic carbene complexes. Coordination Chemistry Reviews. 2004, s. 2247–2273. DOI 10.1016/j.ccr.2004.05.013.
- ↑ R. A. Batey; M. Shen; A. J. Lough. Carbamoyl-Substituted N-Heterocyclic Carbene Complexes of Palladium(II): Application to Sonogashira Cross-Coupling Reactions. Organic Letters. 2002, s. 1411–1414. DOI 10.1021/ol017245g.
- ↑ a b C. Corona; B. K. Bryant; J. B. Arterburn. Synthesis of a Biotin-Derived Alkyne for Pd-Catalyzed Coupling Reactions. Organic Letters. 2006, s. 1883. DOI 10.1021/ol060458r.
- ↑ J. Tulla-Puche; G. Barany. Development of resin-to-resin transfer reactions (RRTR) using Sonogashira chemistry. Tetrahedron. 2005, s. 2195. DOI 10.1016/j.tet.2004.12.029.
- ↑ B.-C. Hong; R. Y. Nimje. Catalytic C-C Bond Formation in Natural Products Synthesis: Highlights From The Years 2000-2005. Current Organic Chemistry. 2006, s. 2191–2225. DOI 10.2174/138527206778742605.
- ↑ a b c Didin Mujahidin; Sven Doye. Enantioselective Synthesis of (+)-(S)-Laudanosine and (−)-(S)-Xylopinine. European Journal of Organic Chemistry. 2005-07-01, s. 2689–2693. DOI 10.1002/ejoc.200500095.
- ↑ J. M. Pedersen; W. R. Bowman; M. R. J. Elsegood; A. J. Fletcher; P. J. Lovell. Synthesis of Ellipticine: A Radical Cascade Protocol to Aryl- and Heteroaryl-Annulated[b]carbazoles. The Journal of Organic Chemistry. 2005, s. 10615–10618. DOI 10.1021/jo0519920.
- ↑ C. Thongsornkleeb; R. L. Danheiser. The coupling of 2-iodo-prop-2-enol with a wide range of acetylenes such as TMSA to give enynyl alcohol, which can be oxidized to the corresponding R-alkynylated acroleins. The Journal of Organic Chemistry. 2005, s. 2364. DOI 10.1021/jo047869a. PMID 15760233.
- ↑ a b L.-X. Shao; M. Shi. Facile Synthesis of 2-Alkynyl Buta-1,3-dienes via Sonogashira Cross-Coupling Methodology. The Journal of Organic Chemistry. 2005, s. 8635–8637. DOI 10.1021/jo051434l. PMID 16209628.
- ↑ L. S. Bleicher; N. D. P. Cosford; A. Herbaut; J. S. McCallum; I. A. McDonald. A Practical and Efficient Synthesis of the Selective Neuronal Acetylcholine-Gated Ion Channel Agonist (S)-(−)-5-Ethynyl-3-(1-methyl-2-pyrrolidinyl)pyridine Maleate (SIB-1508Y). The Journal of Organic Chemistry. 1998, s. 1109–1118. DOI 10.1021/jo971572d.
- ↑ David X. Wang; Heather Booth; Nicole Lerner-Marmarosh; Thomas S. Osdene; Leo G. Abood. Structure-activity relationships for nicotine analogs comparing competition for [3H]nicotine binding and psychotropic potency. Drug Development Research. 1998-09-01, s. 10–16. DOI 10.1002/(SICI)1098-2299(199809)45:1<10::AID-DDR2>3.0.CO;2-G.
- ↑ PARKINSON STUDY, Group. Randomized placebo-controlled study of the nicotinic agonist SIB-1508Y in Parkinson disease. Neurology. 14 February 2006, s. 408–410. DOI 10.1212/01.wnl.0000196466.99381.5c. PMID 16476941.
- ↑ a b M. Bakherad; H. Nasr-Isfahani; A. Keivanloo; N. Doostmohammadi. Pd–Cu catalyzed heterocyclization during Sonogashira coupling: synthesis of 2-benzylimidazo[1,2-a]pyridine. Journal of Organometallic Chemistry. 2008, s. 3819–3822. DOI 10.1016/j.tetlet.2008.03.141.
