Yersinia pestis
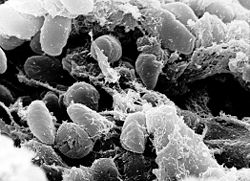 Yersinia pestis pod skenovacím elektronovým mikroskopem | |
| Vědecká klasifikace | |
| Doména | bakterie (Bacteria) |
| Oddělení | Proteobacteria |
| Třída | Gamma Proteobacteria |
| Řád | Enterobacteriales |
| Čeleď | Enterobacteriaceae |
| Rod | Yersinia |
| Binomické jméno | |
| Yersinia pestis (Lehmann & Neumann, 1896) van Loghem 1944 | |
| Některá data mohou pocházet z datové položky. | |
Yersinia pestis (původně Pasteurella pestis) je patogenní gramnegativní bakterie z čeledi Yersiniaceae [1]. Jedná se o fakultativní anaerobní bakterii, která je přenositelná na zvíře i na člověka.
Lidské infekce Yersinií pestis, způsobující mor, se projevují ve třech hlavních formách, které souvisí s místem vstupu infekce do těla. Rozlišujeme formu dýmějovou, septickou (sepse, otrava krve) a plicní.[2] Všechny tyto tři formy jsou odpovědné za vysokou úmrtnost během epidemií v lidské historii, včetně takzvané Černé smrti, jež zahubila nejméně třetinu evropské populace v letech 1347 až 1353.
Dne 13. září 2009 zemřel profesor molekulární genetiky na Chicagské univerzitě, Malcolm J. Casadaban, který se zabýval výzkumem zahrnujícím Y. pestis a jeho smrt byla později dána v souvislost s touto bakterií, kterou se mohl pravděpodobně nakazit ve své vlastní laboratoři.[3]
Y. pestis upoutala pozornost jako možná biologická zbraň a americká CDC (Centers for Disease Control and Prevention) ji označilo jako patogen kategorie A vyžadující přípravu k ochraně před případným teroristickým útokem.
Historie
[editovat | editovat zdroj]Y. pestis objevil Alexandre Yersin, švýcarsko-francouzský fyzik a bakteriolog z Institutu Louise Pasteura v roce 1894 během epidemie dýmějového moru v Hongkongu.[4][5] Yersin byl členem Pasteurovy myšlenkové školy. Šibasaburó Kitasato (北里 柴三郎), japonský bakteriolog školený v Německu, který používal Kochovu metodologii, se také angažoval v nalezení původce moru.[6] Byl to nicméně Yersin, kdo poukázal na souvislost moru s bakterií Yersinia pestis. V roce 1967 byl organismus původně nazvaný Pasteurella pestis přejmenován na své stávající jméno.
Biovary
[editovat | editovat zdroj]Tři biovary Y. pestis jsou považovány za související s historickými pandemiemi bubonického moru.[7]
- Biovar Antiqua je považován za shodující se s Justiniánským morem. Není známo, zda biovar koresponduje i s dřívějšími menšími epidemiemi bubonického moru či dokonce zda se jednalo o pravý bubonický mor.[8]
- Biovar Mediaevalis je domnělým původcem Černé smrti.
- Biovar Orientalis souvisí s třetí pandemií a s většinou novodobých vypuknutí moru. Y. pestis se přenáší blechami (druhy Pulex irritans, Xenopsylla cheopis) napadajícími hlodavce, hlavně krysy.
Soudobá data z typizací multilokulárních sekvencí (MLST) však ukazují, že Y. pestis je klonální, což poněkud vyvrací hypotézu „biovarů“.[9]
Podíl na Černé smrti
[editovat | editovat zdroj]V zubech pravděpodobných obětí Černé smrti i ve středověkých mrtvolách zemřelých z jiných důvodů byla nalezena DNA Y. pestis.[10][11] To naznačuje, že Y. pestis se přinejmenším podílela na některých (i když pravděpodobně ne na všech) evropských morových epidemiích. Je možné, že selektivní tlak způsobený morem mohl změnit způsob, jakým se patogen manifestuje u lidí vyselektovaným v rozporu s jedinci nebo populacemi nejsnadněji podléhajícím.
Současnost
[editovat | editovat zdroj]Světová zdravotnická organizace eviduje každoročně tisíce případů moru, přesto však pomocí náležité léčby je prognóza nakažených již mnohem pozitivnější. Během Vietnamské války se vyskytlo pěti až šestinásobné zvýšení počtu případů, pravděpodobně kvůli narušení ekosystému a větší blízkosti mezi lidmi a zvířaty. Mor má škodlivý účinek také na jiné savce než na člověka. Ve Spojených státech amerických jsou na tuto chorobu léčeny i ohrožené druhy psouna prériového a tchoře černonohého.[zdroj?]
Obecná charakteristika
[editovat | editovat zdroj]Y. pestis je fakultativně anaerobní tyčinkovitá bakterie barvící se bipolárně (na koncích se barví lépe než uprostřed, což ji dává vzezření spínacího špendlíku).[12] Vykazuje negativní výsledky ureázového testu, fermentace laktózy i indolového testu.[13] Y. pestis je více příbuzná s gastrointestinálním patogenem Yersinia pseudotuberculosis a vzdáleněji s Yersinia enterocolitica.
Genom
[editovat | editovat zdroj]Kompletní genetická sekvence je dostupná u dvou ze tří poddruhů Y. pestis: kmen KIM (biovaru Medievalis)[14] a kmen CO92 (biovaru Orientalis, získaného z klinického izolátu ve Spojených státech).[9]. Podobně jako u jiných patogenních kmenů, i zde jsou znaky ztrát funkcí. Chromosom kmene KIM je 4 600 755 bází dlouhý, zatímco chromosom kmene CO92 je dlouhý 4 653 728 párů. Y. pestis, podobně jako jeho příbuzní Yersinia pseudotuberculosis a Yersinia enterocolitica hostí plazmid pCD1. Navíc ještě nese další dva plazmidy a to pPCP (nazývaný také pPla nebo pPst) a pMT1 (jinak pFra), které se nevyskytují u jiných druhů Yersinia. pFra kóduje fosfolipázu D, která je důležitá pro schopnost Y. pestis být přenášena blechami.[15] pPla kóduje Pla proteázu, která aktivuje plazminogen v lidském hostiteli a je velmi důležitým faktorem virulence u plicního moru.[16] Tyto plazmidy, společně s ostrovem patogenity HPI, kódují několik proteinů, které způsobují, že patogenita Y. pestis je tak proslulá. Tyto virulentní faktory jsou mimo jiné vyžadovány pro adhezi bakterie a vstříknutí proteinů do hostitelské buňky, invazi bakterie do buňky a pro získání a vazbu železa z červených krvinek. Y. pestis je považována za nástupce Y. pseudotuberculosis, která se liší jen přítomností specifických virulentních plazmidů.
V roce 2006 byla provedena komplexní komparativní proteomická analýza kmene KIM Y. pestis[17], která se zaměřila na přechod do růstových podmínek napodobujících růst v hostitelských buňkách.
Patogeneze a imunita
[editovat | editovat zdroj]V městských a lesních cyklech Y. pestis dochází k největšímu šíření mezi hlodavci a blechami. U lesních cyklů je hlodavec divoký a naopak u městských cyklů domestikovaný. Y. pestis se navíc může šířit z městského prostředí do lesního a zase zpět. Každé nakažené zvíře může přenést infekci na člověka skrz kontakt s pokožkou. Přenos mezi lidmi může být navíc šířen kýcháním a kašlem anebo přímým kontaktem s nakaženou tkání.
V rezervoárních hostitelích
[editovat | editovat zdroj]Rezervoáry spojené s Y. pestis jsou některé druhy hlodavců. Ve stepi se má za to, že se jedná o sviště. Myslí se, že několik druhů hlodavců ve Spojených státech v sobě udržuje Y. pestis. Argumenty jsou nicméně nejisté, neboť v žádném druhu hlodavců nebyla nalezena očekávaná dynamika choroby. Je známo, že někteří jedinci populace hlodavců mohou mít různou rezistenci, což by mohlo vést k bezpříznakovému stavu.[18] Existuje několik důkazů, že ve vypuknutí lidského moru mohou hrát roli blechy pocházející z jiných savců.[19]
Nedostatek poznatků dynamiky moru u savčích druhů se dostavuje také u podezřelých hlodavčích druhů jako například u psouna prériového (Cynomys ludovicianus), u kterého mor může způsobit zhroucení celé kolonie, což má ve výsledku masivní dopad na prérijní potravní řetězec.[20] Dynamika přenosu u prérijních psů nicméně nesleduje dynamiku u blokovaných blech; důležitou roli mohou hrát i zdechliny a blechy neblokované.[21]
V jiných regionech světa není zdroj infekce jistě identifikován, což komplikuje prevenci a program časného varování. Jedním z těchto případů bylo vypuknutí v Alžírsku v roce 2003.[22]
Infektor
[editovat | editovat zdroj]Přenos Y. pestis blechou je dobře popsán.[23]. K prvotnímu získání Y. pestis vektorem dochází během krmení se na nakaženém zvířeti. K udržení bakterie v zažívacím traktu blechy přispívá několik proteinů například systém skladování heminu (Hms) a Yersinia toxin dobytčího moru (Ymt).
Přestože Ymt je vysoce toxický pro hlodavce a jeho produkce byla považována za potřebnou k zajištění k reinfekci nového hostitele, bylo prokázáno že Ymt je důležitý pro přežití Y. pestis v blechách.[15] Systém Hms hraje důležitou roli v přenosu Y. pestis zpět na savčího hostitele.[24] Proteiny kódované lokusy Hms se shlukují v bleším jícnu a proventriculu, brání bleše v příjmu potravy a zvyšují tak její hladovost. K přenosu Y. pestis dochází pak během marných pokusů blechy o krmení. Pohlcená krev je pumpována do jícnu, kde uvolňuje bakterie zde rostoucí a je neustále chrlena zpět do hostitelského oběhu.
V člověku a dalších vnímavých hostitelích
[editovat | editovat zdroj]K patogenezi během savčích infekcí Y. pestis pomáhá několik faktorů, mimo jiné schopnost této bakterie potlačit normální imunitní odpověď jako například fagocytózu a produkci protilátek. Poté, co bleší kousnutí umožní bakterii přístup skrz kůži, aktivuje Y. pestis yadBC gen, který je podobný k bakteriálním adhezinům u jiných druhů Yersinia, které umožní invazi do epitelových buněk.[25] Y. pestis dále začne expresi aktivátoru plazminogenu, ten je důležitým faktorem virulence u plicní formy moru a může způsobovat krevní sraženiny k usnadnění celkové invaze.[16] Mnoho z virulentních faktorů této bakterie má povahu obrany proti fagocytóze, například dva důležité antigeny jménem F1 (Fraction 1) a V nebo LcrV.[12] Tyto antigen jsou produkovány bakterií za normální teploty lidského těla. Y. pestis kromě toho přežívá a produkuje antigeny F1 a V během spočinutí v krevních elementech jako například monocytech, ale ne v neutrofilech. Přirozená nebo vyvolaná imunita je dosažena produkcí specifických opsonizačních protilátek proti F1 a V antigenům; tyto protilátky by pak umožnily fagocytózu neutrofily.[26]
Navíc bakteriální sekreční systém T III (T3SS) umožní Y. pestis vstříknout své proteiny do makrofágu nebo jiných imunitních buněk. Tyto T3SS proteiny se nazývají YOP (Yersinia Outer Protein) a zahrnují například Yop B/D, který tvoří póry v hostitelské buňce a souvisí s cytolýzou; do póru vytvořeného YopB nebo YopD jsou vstřikovány další proteiny: Yop0, YopH, YopM, YopT, YopJ a YopE, které se mohou vylučovat i do cytoplazmy.[27] Tyto proteiny omezují fagocytózu popřípadě signalizační cesty důležité pro přirozený imunitní systém, jak bude ještě zmíněno.
Y. pestis proliferuje uvnitř lymfatických uzlin, kde je schopna se ubránit zničení buňkami imunitního systému jako například makrofágy a způsobuje tak lymfoadenopatii. YopH je proteinová tyrosin fosfatáza, která přispívá ke schopnosti Y. pestis napadat imunitní systém[28] a která v makrofágu defosforyluje BCAR, vazebné proteiny Fyn, SKAP2 a Pyk a tyrosin kinázu homologní k FAK. YopH se také váže na podjednotku p85 fosfoinositid 3 kinázy, Gab1 a Gab2 adaptorové proteiny a guanin výměnný faktor Vav.
YopE funguje jako protein aktivující GTPázu u členů Rho rodiny GTPáz jako například RAC1. YopT je cystein proteáza, která inhibuje RHOA tím, že odstraní isoprenylovou skupinu, která je důležitá k umístění proteinu v buněčné membráně. Bylo předloženo, že YopE a YopT mohou sloužit k omezení cytolýzy vyvolané YopB/D.[29] To by mohlo zabránit stimulaci imunitní odpovědi, která by byla způsobena prasknutím hostitelské buňky.
YopJ je acetyltransferáza vážící se na konzervovaný alfa helix u MAP kináz.[30] YopJ acetyluje MAP kinázy na serinech a threoninech, které jsou během aktivace MAP kinázové kaskády normálně fosforylované.[31]
Toto narušení aktivity proteinové kinázy u hostitelské buňky způsobí apoptózu makrofágu a považuje se za klíčové k udržení infekce a únik imunitní odpovědi. Yop0, známá také jako Yersinia protein kináza A (YpkA), je vlivným vyvolávacím prvkem apoptózy lidských makrofágů.[32]
Imunita
[editovat | editovat zdroj]Kdysi bývala dostupná formaldehydem inaktivovaná vakcína pro dospělé s vysokým rizikem nákazy, dokud nebyla stažena z trhu úřadem FDA (U.S. Food and Drug Administration). Její účinnost byla omezená a způsobovala těžké záněty. Slibné jsou experimenty s genetickým inženýrstvím založené na F1 a V antigenech, nicméně bakterie s chybějícím F1 antigenem jsou stále virulentní a V antigeny jsou natolik variabilní, že vakcína, sdružující tyto antigeny by nemusela být plně protektivní.[33] Americký armádní Institut lékařského výzkumu infekčních chorob (USAMRIID) zjistil, že experimentální vakcína založena na F1/V antigenu ochrání makaky druhu cynomolgus, ale selhává u afrických zelených opic.[34] Udává se, že Evropané jsou méně náchylní k infekci moru, protože jsou potomky mor přeživších ze středověku.[35]
Klinické aspekty
[editovat | editovat zdroj]Symptomy a vývoj choroby
[editovat | editovat zdroj]Podle postupu choroby se rozeznávají tři její formy:
Též bubonický:
- Inkubační doba 2–6 dnů, kdy se bakterie aktivně množí
- Obecný úbytek energie
- Horečka
- Bolest hlavy a pocit chladu dostavující se náhle na konci inkubační doby. Od tohoto okamžiku infekce buď začne ustupovat, nebo se stane smrtelnou.
- Zvětšení lymfatických uzlin vyúsťující v nadýmající se měchýřky hnisu uvnitř nich, klasický znak dýmějového (bubonického) moru.
- Hnisající ložiska nakonec bolestivě prohnisají i skrz kůži. Úleva však nepřichází, ačkoli už hnis není natlakovaný: Poškozená je nejen kůže, praskly i uzliny. Rány se neuzavírají, naopak přetrvávají jako vředy a nastává celková otrava, sepse.
U „bubonicky“ zánětlivě zvětšených uzlin jsou prvotní symptomy velmi podobné množství jiných chorob, což způsobuje obtíže a zdržuje od včasné diagnózy.[36]
- Hypotenze
- Hepatosplenomegalie
- Delirium
- Záchvaty u dětí
- Šok oběhového systému
- Obecný úbytek energie
- Horečka
- Symptomy bubonického nebo plicního moru, nemusí se však vyskytovat vždy
Jelikož bakterie se pohybuje v krvi, mohou být ovlivněny i jiné orgány, například slezina a mozek. Difúzní infekce může spustit imunologickoou kaskádu, která vede k diseminované intravaskulární koagulaci způsobující krvácení a nekrózu kůže a tkání. Tato roztroušená infekce (sepse) způsobuje úmrtí až ve 22 % případů.
- Horečka
- Pocity chladu
- Kašel
- Bolest hrudníku
- Obtížné dýchání
- Hemoptýza
- Letargie
- Hypotenze
- Šok oběhového systému
- Symptomy bubonického nebo plicního moru, nemusí se však vyskytovat vždy[37]
Stejně jako v ostatních typů moru i zde po odeznění inkubační doby dochází k náhlému nastoupení kašle, vysokých teplot a úbytku sil. Od této chvíle infekce nabývá na vážnosti a kvůli vysoké rychlosti replikace způsobuje léčený mor úmrtí zhruba v 50% případů, neléčený téměř vždy.[38]
Přenos
[editovat | editovat zdroj]- Nejprve se morová nákaza šíří zprostředkovaně přenašeči, proto se i plicní forma vyskytuje až druhotně jako pozdní projev nemoci po lymfatickém zánětu, spolu se septickou formou.
- Plicní mor se může šířit přímo z člověka na člověka aerosolem: Primární plicní nákaza se šíří kapénkově, plíce pak jsou prvním místem infekce. Plicní formy se tedy vyskytují až jako projev síly epidemie.
Kódová označení
[editovat | editovat zdroj]Kódy ICD-10 pro choroby způsobené Y. pestis:
- A20.0 Bubonický mor (dýmějový)
- A20.1 Celulokutanní mor
- A20.2 Plicní forma moru
- A20.3 Morová meningitida
- A20.9 Nespecifikovaný plicní mor
Klinické stanovení
[editovat | editovat zdroj]Gramovo barvení může potvrdit přítomnost gramnegativních tyček a v některých případech identifikovat jejich dvojitě zahnutý tvar. Více určující je Anti-F1 test, který rozlišuje mezi různými druhy Yersinií.
Léčba
[editovat | editovat zdroj]Tradičním lékem první linie při léčbě Y. pestis byl streptomycin[39][40], chloramfenikol, tetracyklin[41] a fluorochinolony. Jsou také dobré důkazy k použití doxycyklinu a gentamicinu.[42] Byly izolovány i rezistentní kmeny a léčba by tak měla být provedena dle citlivosti k antibiotikům. U některých pacientů může být pouhá léčba antibiotiky nedostatečná a je třeba zajistit i oběhovou, ventilační nebo ledvinovou podporu.
V naléhavých případech vyzdvihuje Harrison's Principles of Internal Medicine následující léčbu[37]: Velmi vhodná jsou antibiotika během prvních 24 hodin, přičemž intravenozní podání je upřednostněno u plicního moru nebo pokročilých případů. Streptomycin nebo gentamicin jsou léky první volby a chloramfenikol pro kriticky nemocné pacienty nebo zřídka při podezření na nervové komplikace.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Yersinia pestis na anglické Wikipedii.
- ↑ Family: Yersiniaceae. lpsn.dsmz.de [online]. [cit. 2020-07-14]. Dostupné online.
- ↑ Ryan KJ; Ray CG (editors). Sherris Medical Microbiology. 4. vyd. [s.l.]: McGraw Hill, 2004. Dostupné online. ISBN 0-8385852-9-9. S. 484–8. (anglicky)
- ↑ (anglicky)U. of C. researcher dies after exposure to plague bacteria, chicagobreakingnews.com
- ↑ Bockemühl J. [100 years after the discovery of the plague-causing agent--importance and veneration of Alexandre Yersin in Vietnam today]. Immun Infekt. 1994, roč. 22, čís. 2, s. 72–5. PMID 7959865. (anglicky)
- ↑ Sto let od objevení „morového bacila“, Josef Chalupský, Vesmír 73, 687, 1994/12
- ↑ Howard-Jones N. Was Shibasaburo Kitasato the discoverer of the plague bacillus?. Perspect Biol Med. 1973, roč. 16, čís. 2, s. 292–307. Dostupné online. PMID 4570035. (anglicky)
- ↑ Zhou D, Tong Z, Song Y, Han Y, Pei D, Pang X, Zhai J, Li M, Cui B, Qi Z, Jin L, Dai R, Du Z, Wang J, Guo Z, Wang J, Huang P, Yang R. Genetics of metabolic variations between Yersinia pestis biovars and the proposal of a new biovar, microtus. J Bacteriol. 2004, roč. 186, čís. 15, s. 5147–52. Dostupné online. doi:10.1128/JB.186.15.5147-5152.2004. PMID 15262951. (anglicky)
- ↑ Guiyoule A, Grimont F, Iteman I, Grimont P, Lefevre M, Carniel E. Plague pandemics investigated by ribotyping of Yersinia pestis strains. J Clin Microbiol. 1994, roč. 32, čís. 3, s. 634–41. Dostupné online. PMID 8195371. (anglicky)
- ↑ a b Parkhill, J., B. W. Wren, N. R. Thomson, R. W. Titball, M. T. G. Holden, M. B. Prentice, M. Sebaihia et al. Genome sequence of Yersinia pestis, the causative agent of plague. Nature. 2001, roč. 413, čís. 6855, s. 523–527. doi:10.1038/35097083. PMID 11586360. (anglicky)
- ↑ Drancourt M, Aboudharam G, Signolidagger M, Dutourdagger O, Raoult D. Detection of 400-year-old Yersinia pestis DNA in human dental pulp: An approach to the diagnosis of ancient septicemia. PNAS. 1998, roč. 95, čís. 21, s. 12637–12640. Dostupné online. PMID 9770538. (anglicky)
- ↑ Drancourt M; Raoult D. Molecular insights into the history of plague.. Microbes Infect.. 2002, roč. 4, s. 105–9. doi:10.1016/S1286-4579(01)01515-5. PMID 11825781. (anglicky)
- ↑ a b (anglicky)Collins FM. Pasteurella, Yersinia, and Francisella. In: Baron's Medical Microbiology (Baron S et al, eds.). 4th. vyd. [s.l.]: Univ of Texas Medical Branch, 1996. Dostupné online. ISBN 0-9631172-1-1.
- ↑ (anglicky)Stackebrandt, Erko; Dworkin, Martin; Falkow, Stanley; Rosenberg, Eugene; Karl-Heinz Schleifer. The Prokaryotes: A Handbook on the Biology of Bacteria:Volume 6: Proteobacteria: Gamma Subclass. Berlin: Springer, 2005. ISBN 0-387-25499-4.
- ↑ (anglicky)Deng W et al.. Genome Sequence of Yersinia pestis KIM. Journal of Bacteriology. 2002, roč. 184, čís. 16, s. 4601–4611. Dostupné online. doi:10.1128/JB.184.16.4601-4611.2002. PMID 12142430.
- ↑ a b (anglicky)Hinnebusch BJ, Rudolph AE, Cherepanov P, Dixon JE, Schwan TG, Forsberg A. Role of Yersinia murine toxin in survival of Yersinia pestis in the midgut of the flea vector. Science. 2002, roč. 296, čís. 5568, s. 733–5. doi:10.1126/science.1069972. PMID 11976454.
- ↑ a b (anglicky)Lathem WW, Price PA, Miller VL, Goldman WE. A plasminogen-activating protease specifically controls the development of primary pneumonic plague. Science. 2007, roč. 315, čís. 5811, s. 509–13. doi:10.1126/science.1137195. PMID 17255510.
- ↑ (anglicky)Hixson K et al.. Biomarker candidate identification in Yersinia pestis using organism-wide semiquantitative proteomics.. Journal of Proteome Research. 2006, roč. 5, čís. 11, s. 3008–3017. doi:10.1021/pr060179y. PMID 16684765.
- ↑ (anglicky)MEYER KF. The natural history of plague and psittacosis. Public Health Rep. 1957, roč. 72, čís. 8, s. 705–19. PMID 13453634.
- ↑ (anglicky)von Reyn CF, Weber NS, Tempest B, et al. Epidemiologic and clinical features of an outbreak of bubonic plague in New Mexico. J. Infect. Dis.. 1977, roč. 136, čís. 4, s. 489–94. Dostupné online. PMID 90884.
- ↑ (anglicky)Pauli JN, Buskirk SW, Williams ES, Edwards WH. A plague epizootic in the black-tailed prairie dog (Cynomys ludovicianus). J. Wildl. Dis.. 2006, roč. 42, čís. 1, s. 74–80. PMID 16699150.
- ↑ (anglicky)Webb CT, Brooks CP, Gage KL, Antolin MF. Classic flea-borne transmission does not drive plague epizootics in prairie dogs. Proc. Natl. Acad. Sci. U.S.A.. 2006, roč. 103, čís. 16, s. 6236–41. doi:10.1073/pnas.0510090103. PMID 16603630.
- ↑ (anglicky)Bertherat E, Bekhoucha S, Chougrani S, et al. Plague Reappearance in Algeria after 50 Years, 2003. Emerging Infect. Dis.. 2007, roč. 13, čís. 10, s. 1459–1462. PMID 18257987.
- ↑ (anglicky)Zhou D, Han Y, Yang R. Molecular and physiological insights into plague transmission, virulence and etiology. Microbes Infect.. 2006, roč. 8, čís. 1, s. 273–84. doi:10.1016/j.micinf.2005.06.006. PMID 16182593.
- ↑ (anglicky)B.J. Hinnebusch, R.D. Perry and T.G. Schwan. Role of the Yersinia pestis hemin storage (hms) locus in the transmission of plague by fleas. Science.. 1996, roč. 8, čís. 1, s. 367–70. doi:10.1126/science.273.5273.367. PMID 8662526.
- ↑ (anglicky)Forman S, Wulff CR, Myers-Morales T, Cowan C, Perry RD, Straley SC. yadBC of Yersinia pestis, a new virulence determinant for bubonic plague. Infect. Immun.. 2008, roč. 76, čís. 2, s. 578–87. Dostupné online. doi:10.1128/IAI.00219-07. PMID 18025093.
- ↑ (anglicky)Salyers AA, Whitt DD. Bacterial Pathogenesis: A Molecular Approach. 2nd. vyd. [s.l.]: ASM Press, 2002. pp. 207-12.
- ↑ (anglicky)Viboud GI, Bliska JB. Yersinia outer proteins: role in modulation of host cell signaling responses and pathogenesis. Annu. Rev. Microbiol.. 2005, roč. 59, s. 69–89. Dostupné online. doi:10.1146/annurev.micro.59.030804.121320. PMID 15847602.
- ↑ (anglicky)de la Puerta ML, Trinidad AG, del Carmen Rodríguez M, Bogetz J, Sánchez Crespo M, Mustelin T, Alonso A, Bayón Y. Characterization of new substrates targeted by Yersinia tyrosine phosphatase YopH. PLoS ONE. February 2009, roč. 4, čís. 2, s. e4431. Dostupné online. doi:10.1371/journal.pone.0004431. PMID 19221593.
- ↑ (anglicky)Mejía E, Bliska JB, Viboud GI. Yersinia controls type III effector delivery into host cells by modulating Rho activity. PLoS ONE. February 2009, roč. 4, čís. 2, s. e4431. Dostupné online. doi:10.1371/journal.ppat.0040003. PMID 18193942.
- ↑ (anglicky)Hao YH, Wang Y, Burdette D, Mukherjee S, Keitany G, Goldsmith E, Orth K. Structural requirements for Yersinia YopJ inhibition of MAP kinase pathways. PLoS ONE. January 2008, roč. 2, čís. 3, s. e1375. Dostupné online. doi:10.1371/journal.pone.0001375. PMID 18167536.
- ↑ (anglicky)Monack DM, Mecsas J, Ghori N, Falkow S. Yersinia signals macrophages to undergo apoptosis and YopJ is necessary for this cell death. Proc Natl Acad Sci U S A.. September 1997, roč. 94, čís. 19, s. 10 385 – 10 390. Dostupné online. PMID 9294220.
- ↑ (anglicky)Park H, Teja K, O'Shea JJ, Siegel RM. The Yersinia effector protein YpkA induces apoptosis independently of actin depolymerization. J Immunol.. May 2007, roč. 178, čís. 10, s. 6426–6434. Dostupné online. PMID 17475872.
- ↑ (anglicky)Welkos S et al.. Determination of the virulence of the pigmentation-deficient and pigmentation-/plasminogen activator-deficient strains of Yersinia pestis in non-human primate and mouse models of pneumonic plague. Vaccine. 2002, roč. 20, s. 2206–2214. doi:10.1016/S0264-410X(02)00119-6. PMID 12009274.
- ↑ CENTER FOR BIOLOGICS EVALUATION AND RESEARCH. DEPARTMENT OF HEALTH AND HUMAN RESOURCES FOOD AND DRUG ADMINISTRATION. In: [Workshop on Animal Models and Correlates of Protection for Plague Vaccines]. [s.l.]: [s.n.], Wednesday, October 13, 2004. Přepis přednášky Nonhuman Primates as a Model for Pneumonic Plague, s. 222–248. (anglicky)
- ↑ KLUNK, Jennifer; VILGALYS, Tauras P.; DEMEURE, Christian E. Evolution of immune genes is associated with the Black Death. Nature. 2022-11-10, roč. 611, čís. 7935, s. 312–319. Dostupné online [cit. 2022-11-16]. ISSN 0028-0836. doi:10.1038/s41586-022-05349-x. PMID 36261521. (anglicky)
- ↑ (anglicky)Prentice MB, Rahalison L. Plague. Lancet. 2007, roč. 369, čís. 9568, s. 1196–207. Dostupné online. doi:10.1016/S0140-6736(07)60566-2. PMID 17416264.
- ↑ a b (anglicky)Jameson, J. N. St C.; Dennis L. Kasper; Harrison, Tinsley Randolph; Braunwald, Eugene; Fauci, Anthony S.; Hauser, Stephen L; Longo, Dan L. Harrison's principles of internal medicine. New York: McGraw-Hill Medical Publishing Division, 2005. ISBN 0-07-140235-7.
- ↑ (anglicky)Riedel S. Plague: from natural disease to bio-terrorism. Proc (Bayl Univ Med Cent). 2005, roč. 18, čís. 2, s. 116–24. PMID 16200159.
- ↑ (anglicky)Wagle PM. Recent advances in the treatment of bubonic plague. Indian J Med Sci. 1948, roč. 2, s. 489–94.
- ↑ (anglicky)Meyer KF. Modern therapy of plague. JAMA. 1950, roč. 144, s. 982–5. Dostupné online. PMID 14774219.
- ↑ (anglicky)Kilonzo BS, Makundi RH, Mbise TJ. A decade of plague epidemiology and control in the Western Usambara mountains, north-east Tanzania. Acta Tropica. 1992, roč. 50, s. 323–9. doi:10.1016/0001-706X(92)90067-8. PMID 1356303.
- ↑ (anglicky)Mwengee W, Butler T, Mgema S, et al.. Treatment of plague with gentamicin or doxycycline in a randomized clinical trial in Tanzania. Clin Infect Dis. 2006, roč. 42, s. 614–21. doi:10.1086/500137. PMID 16447105.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Yersinia pestis na Wikimedia Commons
Obrázky, zvuky či videa k tématu Yersinia pestis na Wikimedia Commons  Galerie Yersinia pestis na Wikimedia Commons
Galerie Yersinia pestis na Wikimedia Commons Taxon Yersinia pestis ve Wikidruzích
Taxon Yersinia pestis ve Wikidruzích- (anglicky) Yersinia pestis Archivováno 29. 6. 2006 na Wayback Machine., bacteriamuseum.org, virtuální muzeum bakterií
- (anglicky) NCBI taxonomy browser, ncbi.nlm.nih.gov, seznam variant kmenů a mnohé další informace
- (anglicky) CDC Domovská stránka moru, cdc.gov
- (anglicky) IDSA Zdroje informací o moru Archivováno 14. 6. 2011 na Wayback Machine., cidrap.umn.edu

Přečtěte si prosím pokyny pro využití článků o zdravotnictví.
