Wittigova reakce
Wittigova reakce je reakce aldehydu nebo ketonu s trifenylfosfoniumylidem za vzniku alkenu a trifenylfosfinoxidu.[1][2]
Objevil ji německý chemik Georg Wittig v roce 1954; roku 1979 získal za tento objev Nobelovu cenu za chemii. Používá se v organické syntéze na přípravu alkenů.[3][4][5]
Nejčastěji se Wittigova reakce provádí s monosubstituoovanými trifenylfosfoniumylidy. Při reakci s aldehydy lze geometrii produktu snadno předpovědět na základě vlastností ylidu. U nestabilizovaných ylidů (tedy pokud je R3 alkyl) vznikají, se střední až vysokou stereoselektivitou, převážně Z-alkeny. U stabilizovaných ylidů (R3 je esterová nebo ketonová skupina) se tvoří E-alkeny s vysokou selektivitou. V případě částečně stabilizovaných ylidů (R3 = aryl) je E/Z selektivita často nízká.[6]
K získání E-alkenů z nestabilizovaných ylidů je možné využít Schlosserovu modifikaci Wittigovy reakce, případně Hornerovu–Wadsworthovu–Emmonsovu reakci.
Mechanismus
[editovat | editovat zdroj]Původně navržený mechanismus
[editovat | editovat zdroj]Sterické efekty vyvolané ylidem 1 způsobí, že převažujícím produktem nukleofilní adice bude betain 3.
Rotací vazby mezi dvěma uhlíky vznikne betain 4, jenž se následně přemění na oxafosfetan 5. Z něj poté vznikne trifenylfosfinoxid 6 a Z-alken 7. U reakcí jednodušších Wittigových reaktantů probíhá dobře reakce s aldehydy i ketony; krokem určujícím rychlost reakce je přeměna betainu na meziprodukt 5. Při použití stabilizovaných ylidů (tedy takových, kde skupina R1 stabilizuje záporný náboj) však nejpomaleji probíhá první krok, a rychlost tvorby alkenu se tak snižuje a vzniká větší množství E-izomeru. Tímto lze vysvětlit nízkou reaktivitů při použití stericky stíněných ketonů.
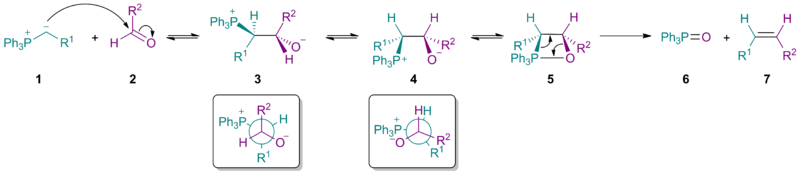
Výzkum mechanismu
[editovat | editovat zdroj]Ve studiích zabývajících se mechanismem Wittigovy reakce se zkoumají převážně reakce s nestabilizovanými ylidy, protože jejich meziprodukty lze snadno identifikovat pomocí spektroskopie nukleární magnetické rezonance (NMR spektroskopie). Existence a vzájemné přeměny betainů (3a a 3b) jsou stále předmětem výzkumu.[7]
Při Wittigových reakcích prováděných bez použití lithia podle většiny studií vzniká oxafosfetan bez vlivu betainu. Fosfoniumylid 1 se přímo přeměňuje reakcí s karbonylovou sloučeninou 2 v 2 cykloadici oxafosfetany 4a a 4b, aniž by se vytvářel betain. Stereochemii produktu ovlivňuje hlavně kineticky řízená adice ylidu 1 na karbonylovou sloučeninu 2. Za přítomnosti lithia dojde k vytvoření rovnováhy meziproduktů, přičemž reakce pravděpodobně probíhá přes betainové meziprodukty 3a a 3b.[8][9][10] Dlouho se předpokládalo, že stereochemie Wittigovy reakce, s ohledem na vznik vazby uhlík-uhlík, má přímou souvislost se Z/E stereochemií produktu; u některých reaktantů to ovšem neplatí. Tuto odchylku mohou způsobovat také lithné soli.[11]
Přesná podoba mechanismu závisí na tom, zda se použije alifatický nebo aromatický aldehyd a alifatický či aromatický fosfoniumylid. Wittigovqa reakce nerozvětvených aldehydů prováděná za přítomnosti lithných solí nevede k vytvoření rovnováhy a reakce je tak řízená kineticky.[12][13] E. Vedejs vytvořil teorii vysvětlující stereoselektivitu stabilizovaných a nestabilizovaných Wittigových reakcí.[14]

V roce 2013 bylo zjištěno, že za nepřítomnosti lithných solí probíhají pravděpodobně všechny reakce nestabilizovaných (R1 = alkyl, H), částečně stabilizovaných(R1 = aryl) a stabilizovaných (R1 je skupina odtahující elektrony) Wittigových reaktantů [2+2]/retro-[2+2] mechanismem jako kineticky řízené reakce, při kterých je oxafosfetan jediným meziproduktem.[15]
Reaktanty
[editovat | editovat zdroj]Příprava fosfoniumylidů
[editovat | editovat zdroj]Fosfoniumylidy se obvykle připravují z fosfoniových solí, které se získávají reakcí trifenylfosfinu s alkylhalogenidy. Alkylfosfoniové soli se následně deprotonují pomocí silné zásady jako je N-butyllithium:
- [(C6H5)3P+CH2R]X− + C4H9Li → (C6H5)3P=CHR + LiX + C4H10
Lze použít také terc-butoxid draselný, lithné sodné a draselné hexamethyldisilazidy (LiHMDS, NaHMDS, KHDMS, kde HDMS = N(Si(CH3)3)2 nebo hydrid sodný (NaH). U Wittigových reaktantů stabilizovaných skupinami odtahujícími elektrony jsou dostačující i poměrně slabé zásady jako hydroxid sodný a uhličitan draselný.
Výběr vhodné zásady je důležitý, protože meziprodukt(y) vznikající při deprotonaci mají významný vliv na účinnost reakce a stereochemii produktů.
Jedním z nejjednodušších ylidů je methylentrifenylfosforan ((C6H5)3P=CH2).[16] Jeho alkylací primárními alkylhalogenidy vznikají substituované fosfoniové soli.
- (C6H5)3P=CH2 + RCH2X → (C6H5)3P+ CH2CH2R X−
Tyto soli lze deprotonovat na (C6H5)3P=CH−CH2R.
Struktura ylidů
[editovat | editovat zdroj]
Struktura Wittigových reaktantů se popisuje v fosforanové nebo ylidové podobě:
Uhlíkový atom v ylidové formě má vlastnosti nukleofilu.
Reaktivita
[editovat | editovat zdroj]Jednoduché fosforany obvykle snadno reagují a také podléhají hydrolýze. Připravují se za nepřístupu vzduchu. Fosforany, které mají na uhlíkový atom navázanou skupinu odtahující elektrony, jsou stabilnější; patří k nim mimo jiné trifenylkarbetoxymethylenfosforany [(C6H5)3P=CHCO2R] a (C6H5)3P=CHC6H5. Tyto ylidy jsou dostatečně stabilní na to, aby mohly být komerčně dostupné.[17]

Fosfoniové soli odvozené od esterů kyseliny chloroctové se vytváří poměrně jednoduše, dostačuje při tom přítomnost hydroxidu sodného (NaOH) a na vzduchu jsou většinou stabilnější než ylidy; příslušné fosforany jsou ovšem méně reaktivní, jelikož nemají skupiny odtahující elektrony, například často nereagují s ketony a je třeba použít Hornerovu–Wadsworthovu–Emmonsovu reakci. Při reakci těchto ylidů většinou vznikají E-alkeny namísto Z-alkenů, které jsou obvyklejšími produkty Wittigovy reakce.
I když mají fosforany vysokou elektronovou hustotu, tak jsou často náchylné na deprotonace. Reakcí (CH3)3PCH2 s butyllithiem vzniká (CH3)2P(CH2)2Li.[18]
Ylidy se chovají jako karboanionty a tak mohou být ligandy;[19] například (CH3)2P(CH2)2Li je bidentátní ligand.[18]

Využití a omezení
[editovat | editovat zdroj]Wittigova reakce je oblíbeným postupem při přípravě alkenů z ketonů a aldehydů. Lze ji provádět s karbonylovými sloučeninami obsahujícími různé funkční skupiny, jako jsou hydroxyl (-OH), alkoxyskupina (-OR), nitroskupina (-NO2) a esterová skupina (R-C(O)-O-R'). Problémy mohou nastat u stericky ovlivněných ketonů, kdy reakce probíhá pomalu a má nízkou výtěžnost, obzvlášť se stabilizovanými ylidy, v takových případech se obvykle místo toho provádí Hornerova–Wadsworthova–Emmonsova reakce.
Aldehydy mohou také podléhat oxidaci, polymerizaci nebo rozkladu. Tomu se lze vyhnout prostřednictvím oxidační Wittigovy reakce, kdy se aldehyd připravuje těsně před použitím oxidací odpovídajícího alkoholu.[21]
Wittigovy reaktanty se obvykle připravují z primárních alkylhalogenidů; reakce trifenylfosfinu s většinou sekundárních alkylhalogenidů není dostatečně účinná. Z tohoto důvodu se Wittigova reakce jen výjimečně využívá k přípravě tetrasubstituovaných alkenů. Lze ji však použít k získání produktů s alkenovými a aromatickými skupinami a reaktanty mohou obsahovat etherové, esterové a nitrilové funkční skupiny. Je také možné použít bis-ylidy (obsahující dvě vazby P=C).
Reakce je také omezována stereochemií produktu. Při použití jednoduchých ylidů je produktem obvykle Z-alken, i když se může tvořit i menší množství E-izomeru, obzvláště při použití ketonů. Při provedení reakce v dimethylformamidu za přítomnosti jodidu lithného nebo sodného je produktem téměř výhradně Z-izomer.
[22] Jestliže je třeba získat E-alken, tak se použije Schlosserova modifikace. Reakcí stabilizovaných ylidů vznikají převážně E-alkeny, podobně jako u Hornerovy–Wadsworthovy–Emmonsovy reakce.
Schlosserova modifikace
[editovat | editovat zdroj]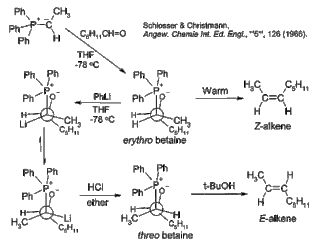
Hlavním nedostatkem klasické Wittigovy reakce je skutečnost, že reakce probíhá převážně přes erythrobetain, ze kterého se následně tvoří Z-alken. Erythrobetain lze přeměnit na threobetain, ze kterého vznikne E-alken, přidáním fenyllithia za nízké teploty.[23]
Reakcí ylidu betainu s dalším aldehydem je možné připravit alkoholy s allylovou skupinou v molekule.[24]
Příklady
[editovat | editovat zdroj]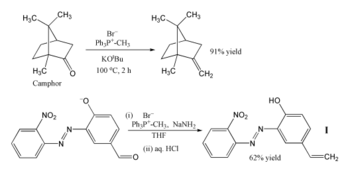
Vzhledem k mnoha možným způsobům využití se Wittigova reakce v organické syntéze využívá poměrně často.[25] Nejčastějším využitím je zavedení methylenové skupiny do sloučenin pomocí methylentrifenylfosforanu [(C6H5)3P=CH2]. Při jeho použití i stericky ovlivněné ketony jako je kafr mohou být přeměněny na své methylenové deriváty. Wittigův reaktant se v tomto případě připravuje těsně před použitím deprotonací methyltrifenylfosfoniumbromidu terc-butoxidem draselným.[26] Fosforan lze také připravit za použití amidu sodného jako zásady a následně přeměnit aldehyd na alken s 62% výtěžností.[27] Reakce probíhá za nízké teploty v tetrahydrofuranu, přičemž mohou být přítomny jinak nežádoucí nitro, azo a fenoxidové skupiny.
Wittigova reakce se rovněž uplatňuje při přípravě methylesteru leukotrienu A.[28][29] V prvním kroku se karbonylová skupina konjuguje se stabilizovaným ylidem, čímž se zabraňuje kondenzační reakci, vzniká však převážně cis produkt. Epoxidová a esterová skupina nejsou reakcí zasaženy.

Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Wittig reaction na anglické Wikipedii.
- ↑ Georg Wittig; Ulrich Schöllkopf. Über Triphenyl-phosphin-methylene als olefinbildende Reagenzien I. Chemische Berichte. 1954, s. 1318.
- ↑ Georg Wittig; Werner Haag. Über Triphenyl-phosphin-methylene als olefinbildende Reagenzien II. Chemische Berichte. 1955, s. 1654–1666.
- ↑ Maercker, A. Org. React. 1965, 14, 270–490. (Review)
- ↑ W. Carruthers, Some Modern Methods of Organic Synthesis, Cambridge University Press, Cambridge, UK, 1971, 81–90. (ISBN 0-521-31117-9)
- ↑ R. W. Hoffmann. Wittig and His Accomplishments: Still Relevant Beyond His 100th Birthday. Angewandte Chemie International Edition. 2001, s. 1411–1416. PMID 11317288.
- ↑ Raphaël Robiette; Jeffery Richardson; Varinder K. Harvey. Reactivity and Selectivity in the Wittig Reaction: A Computational Study. Journal of the American Chemical Society. 2006, s. 2394–2409. ISSN 0002-7863. PMID 16478195.
- ↑ E. Vedejs; C. F. Marth. Mechanism of Wittig reaction: evidence against betaine intermediates. Journal of the American Chemical Society. 1990, s. 3905–3909.
- ↑ Bruce E. Maryanoff, A. B. Reitz, M. S. Mutter, R. R. Inners, and H. R. Almond, Jr., "Detailed Rate Studies on the Wittig Reaction of Non-Stabilized Phosphorus Ylides via 31P, 1H, and 13C NMR Spectroscopy. Insight into Kinetic vs. Thermodynamic Control of Stereochemistry", J. Am. Chem. Soc., 107, 1068–1070 (1985)
- ↑ Bruce E. Maryanoff, A. B. Reitz, D. W. Graden, and H. R. Almond, Jr., "NMR Rate Study on the Wittig Reaction of 2,2-Dimethylpropanal and Tributylbutylidene-phosphorane", Tetrahedron Lett., 30, 1361–1364 (1989)
- ↑ Bruce E. Maryanoff, A. B. Reitz, M. S. Mutter, R. R. Inners, H. R. Almond, Jr., R. R. Whittle, and R. A. Olofson, "Stereochemistry and Mechanism of the Wittig Reaction. Diastereomeric Reaction Intermediates and Analysis of the Reaction Course", J. Am. Chem. Soc., 108, 7664–7678 (1986)
- ↑ A. B. Reitz, S. O. Nortey, A. D. Jordan, Jr., M. S. Mutter, and Bruce E. Maryanoff, "Dramatic Concentration Dependence of Stereochemistry in the Wittig Reaction. Examination of the Lithium-Salt Effect", J. Org. Chem., 51, 3302–3308 (1986)
- ↑ E. Vedejs; C. F. Marth; R. Ruggeri. Substituent effects and the Wittig mechanism: the case of stereospecific oxaphosphetane decomposition. Journal of the American Chemical Society. 1988, s. 3940–3948.
- ↑ E. Vedejs; C. F. Marth. Mechanism of the Wittig reaction: the role of substituents at phosphorus. Journal of the American Chemical Society. 1988, s. 3948–3958.
- ↑ Vedejs, E.; Peterson, M. J. Top. Stereochem. 1994, 21, 1.
- ↑ Peter A. Byrne; Declan G. Gilheany. Mechanism of the Wittig reaction: the role of substituents at phosphorus. Chemical Society Reviews. 2013, s. 6670. ISSN 0306-0012.
- ↑ GEORG WITTIG U. SCHOELLKOPF. Methylenecyclohexane (describes Ph3PCH2. Org. Synth.. 1973. Dostupné online.; Coll. Vol.. S. 751.
- ↑ (Carbethoxymethylene)triphenylphosphorane [online]. Sigma-Aldrich [cit. 2019-06-27]. Dostupné online.
- ↑ a b J. P. Fackler; J. D. Basil. Oxidative Addition of Methyl Iodide to a Dinuclear gold(I) Complex. The X-Ray Crystal Structure of Bis[mu-(Dimethyldimethylenephosphoranyl-C,C)]-iodomethyldigold(II)(Au-Au), Au2[(CH2)2P(CH3)2]2(CH3)I. Organometallics. 1982, s. 871–873.
- ↑ H. Schmidbaur. Phosphorus Ylides in the Coordination Sphere of Transition Metals: An Inventory. Angewandte Chemie International Edition in English. 1983, s. 907–927.
- ↑ Ralf Tonner; Florian Oexler; Bernhard Neumueller; Wolfgang Petz; Gernot Frenking. Carbodiphosphoranes: The Chemistry of Divalent Carbon(0). Angewandte Chemie International Edition. 2006, s. 8038–8042. PMID 17075933.
- ↑ RICHARD J. K. TAYLOR, LEONIE CAMPBELL, AND GRAEME D. MCALLISTER. (±) trans-3,3'-(1,2-Cyclopropanediyl)bis-2-(E)-propenoic Acid, Diethyl Ester: Tandem Oxidation Procedure (TOP) using MnO2 Oxidation-Stabilized Phosphorane Trapping. Org. Synth.. 2008, s. 15–26. Dostupné online.
- ↑ L. D. Bergelson; M. M. Shemyakin. Synthesis of Naturally Occurring Unsaturated Fatty Acids by Sterically Controlled Carbonyl Olefination. Angewandte Chemie. 1964, s. 250–260.
- ↑ M. Schlosser; K. F. Christmann. Trans-Selective Olefin Syntheses. Angewandte Chemie International Edition in English. 1966, s. 126.
- ↑ Elias James Corey; H. Yamamoto. Modification of the Wittig reaction to permit the stereospecific synthesis of certain trisubstituted olefins. Stereospecific synthesis of α-santalol. Journal of the American Chemical Society. 1970, s. 226–228.
- ↑ B. E. Maryanoff; A. B. Reitz. The Wittig olefination reaction and modifications involving phosphoryl-stabilized carbanions. Stereochemistry, mechanism, and selected synthetic aspects. Chemical Reviews. 1989, s. 863–927.
- ↑ Fitjer, L.; Quabeck, U. Synthetic Communications 1985, 15(10), 855–864.
- ↑ F. A. Bottino; G. Di Pasquale; A. Pollicino; A. Recca; D. T. Clark. Synthesis of 2-(2-hydroxyphenyl)-2H-benzotriazole monomers and studies of the surface photostabilization of the related copolymers. Macromolecules. 1990, s. 2662–2666. Bibcode 1990MaMol..23.2662B.
- ↑ I. Ernest; A. J. Main; R. Menasse. Synthesis of the 7-cis isomer of the natural leukotriene d4. Tetrahedron Letters. 1982, s. 167–170.
- ↑ E. J. Corey; D. A. Clark; G. Goto; A. Marfat; C. Mioskowski; B. Samuelsson; S. Hammarstroem. Stereospecific total synthesis of a "slow reacting substance" of anaphylaxis, leukotriene C-1. Journal of the American Chemical Society. 1980, s. 1436–1439.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Wittigova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Wittigova reakce na Wikimedia Commons


