Wikipedistka:Sladovnik/Transmembránový receptor
Signální transdukce[editovat | editovat zdroj]

Signální transdukce procesů přes membránové receptory zahrnují vnější reakce, ve kterém je ligand se váže na membránový receptor, a vnitřní reakce, v nichž intracelulární reakce je spuštěna.[1][2]
Transdukce signálu prostřednictvím membránových receptorů vyžaduje čtyři části:
- Extracelulární signální molekuly: extracelulární signální molekula je produkován jednu buňku a je alespoň schopen cestovat do sousedních buněk.
- Receptorový protein: buňky musí mít buňky povrchu receptor proteiny, které se váží na signalizační molekuly a komunikovat směrem dovnitř do buňky.
- Intracelulární signální proteiny: tyto předat signál do organel z buňky. Vazba signální molekuly na receptor protein aktivuje intracelulární signální proteiny, které iniciují signální kaskádu.
- Cílové proteiny: konformací nebo jiné vlastnosti cíle bílkoviny jsou změněny, když je signální dráha je aktivní a mění chování buňky.

Membránové receptory jsou rozděleny především podle struktury a funkce do 3 tříd: iontový kanál spojený receptor, enzym-linked receptor; a G protein-coupled receptor.
- Iontový kanál spojený receptory mají iontové kanály pro anionty a kationty a tvoří velkou rodinu multipass transmembránové proteiny. Účastní se v rychlé signalizační vlněi obvykle v elektricky aktivních buněk jako jsou neurony. NAzávají se často ligand-gated iontové kanály. Otevírání a zavírání iontových kanálů je řízeno neurotransmitery.
- Enzyme-linked receptory jsou buď enzymy sami nebo přímo aktivují asociované enzymy . Tyto jsou obvykle single-pass transmembránové receptory s enzymatickou složkou intracelulární. Většina enzyme-linked receptory jsou, nebo se sdružují s kinázami.
- G protein-coupled receptorů jsou integrální membránové proteiny, které mají sedm transmembránových helixů. Tyto receptory aktivují G protein navázáním na agonista , a G-protein receptor zprostředkovává účinky na intracelulární signální dráhy.
Spřažení s iontovým kanálem[editovat | editovat zdroj]
Během transdukce signálu v případě neuronu, neurotransmiter se váže na receptor a mění konformaci proteinu. Otevře se iontový kanál, který umožňuje extracelulární ionty do buňky. Iontové propustnosti plazmatické membrány je změněn, a to transformuje extracelulární chemický signál do intracelulárního elektrický signál, který mění buněčné dráždivosti.[3]
Acetylcholine receptor je receptor spojený s kationtový kanál. Protein se skládá ze 4 podjednotek: α, β, γ, a δ podjednotky. Tam jsou dvě α podjednotky, s jedním acetylcholinové vazebné místo pro každého. Tento receptor může existovat ve třech konformacích. Uzavřené a neobydlené státu je nativní konformaci bílkovin. Jako dvě molekuly acetylcholinu obě se vážou na vazebná místa α-podjednotek, konformace receptoru se změní a otevře vrata, umožňující vjezd mnoho iontů a malých molekul. Nicméně, toto otevřené a obsazené stav trvá pouze za menší dobu a pak brána je zavřená, se stal uzavřený a okupovaných států. Dvě molekuly acetylcholinu se brzy oddělí od receptoru, návratem do rodné uzavřené a neobydlené státu.[4][5]
Enzyme-linked receptory[editovat | editovat zdroj]
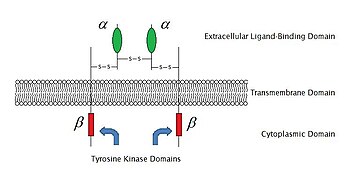
Od roku 2009, tam jsou 6 známé typy enzyme-linked receptory: Receptor tyrosin kináz; Tyrosin kinázy spojené receptory; Receptor-like tyrosin fosfatáz; Receptory serin/threonin kináz; Receptor guanylyl cyclases a histidin kinázy spojené receptory. Receptor tyrosin kinázy mají největší počet obyvatel a nejširší uplatnění. Většina těchto molekul jsou receptory pro růstové faktory jako například epidermální růstový faktor (EGF), krevních destiček odvozený růstový faktor (PDGF), fibroblastový růstový faktor (FGF), hepatocytární růstový faktor (HGF), nervový růstový faktor (NGF) a hormony, jako je inzulín. Většina z těchto receptorů se dimerizovat po závazné s jejich ligandy, aby bylo možné aktivovat další signální transductions. Například, po epidermální růstový faktor (EGF)na receptor naváže jeho ligand EGF, dva receptory dimerizovat a pak podstoupit fosforylace na tyrosinových zbytků v enzymu část každé receptorové molekuly. Tím se aktivuje tyrosin kinázu a katalyzovat další intracelulární reakce.
G protein-coupled receptorů[editovat | editovat zdroj]
G protein-coupled receptory obsahují velké proteinové rodiny transmembránových receptorů. Nacházejí se pouze v eukaryot.[6] Na ligandy , které se váží a aktivovat tyto receptory patří: fotosenzitivní sloučeniny, vůně, feromony, hormonya neurotransmitery. Ty se liší ve velikosti od malých molekul peptidů a velkými proteiny. G protein-coupled receptory jsou zapojeny v mnoha chorob, a proto jsou cíle mnoha moderních léčiv.[7]
Tam jsou dvě hlavní signální transdukční zahrnující G-protein vázané receptory: cAMP signální dráhy a fosfatidyl signální dráhy.[8] Oba jsou zprostředkovány prostřednictvím G proteinů aktivace. G-protein je trimerní protein, s tří podjednotek označených jako α, β, a γ. V reakci na aktivační receptor, α podjednotka se uvolní vázané guanosin difosfát (GDP), který je posunut o guanosin trifosfát (GTP), tedy aktivaci α podjednotky, které se pak odloučí od β a γ podjednotky. Aktivovaná α podjednotka může mít dále vliv na intracelulární signální proteiny ani cílové funkční proteiny přímo.
Membránové receptor-související s nemocí[editovat | editovat zdroj]
Pokud membránové receptory jsou denaturované nebo nedostatečné, signální transdukce může být narušen a způsobit onemocnění. Některé nemoci jsou způsobeny poruchy membránového receptoru funkce. To je vzhledem k nedostatku nebo degradace receptoru prostřednictvím změny v genech, které kódují a regulovat receptor protein. Membránový receptor TM4SF5 vlivy migrace jaterní buňky a hepatomu.[9] Také, kortikální NMDA receptor ovlivňuje plynulost membrány, a je změněn u Alzheimerovy choroby.[10] Když buňka je napaden neobaleného viru, virus se nejprve váže na specifické membránové receptory, a pak prochází sám nebo subviral složkou cytoplazmatické straně buněčné membrány. V případě polioviru, je známo, in vitro interakce s receptory způsobí konformační změnu, která uvolní virion protein nazvaný VP4.N terminus VP4 je myristylated a tedy hydrofobní【kyseliny myristové=CH3(CH2)12COOH】. To je navrhl, že konformační změny vyvolané vazbou na receptor v důsledku připevnění kyseliny myristové na VP4 a vytvoření kanálu pro RNA.
Structure-based drug design[editovat | editovat zdroj]

Prostřednictvím metod, jako jsou X-ray krystalografie a NMR spektroskopie, informace o 3D struktur cílových molekul se dramaticky zvýšil, a tak má strukturální informace o ligandy. To pohání rychlý rozvoj structure-based drug design. Některé z těchto nových léků cíl membránové receptory. Současné přístupy ke struktuře-based drug design může být rozdělena do dvou kategorií. První kategorie je o stanovení ligandy pro daný receptor. To je obvykle dosaženo prostřednictvím databázových dotazů, biofyzikální simulace a konstrukce chemických knihoven. V každém případě, velký počet potenciální ligand molekuly jsou promítány najít ty, montáž vazebné kapsy receptoru. Tento přístup se obvykle označuje jako ligand-based drug design. Hlavní výhodou hledání databáze je, že to šetří čas a sílu k získání nových účinných sloučenin. Další přístup structure-based drug design je o combinatorially mapování ligandy, který je označován jako receptor-based drug design. V tomto případě, ligand molekuly jsou navrženy v rámci omezení závazné kapsy spojením malé kousky v krocích. Tyto kusy mohou být buď atomy nebo molekuly. Hlavní výhodou této metody je, že nové struktury mohou být objeveny.[11][12][13]
- ↑ Ullricha A.,Schlessingerb J.; SCHLESSINGER, J. Signal transduction by receptors with tyrosine kinase activity. Cell. 1990, s. 203–212. DOI 10.1016/0092-8674(90)90801-K. PMID 2158859.
- ↑ [s.l.]: [s.n.] ISBN 0-471-41090-X.
- ↑ [s.l.]: [s.n.] ISBN 0-87893-321-2.
- ↑ Miyazawa A.; FUJIYOSHI Y.; UNWIN N. Structure and gating mechanism of the acetylcholine receptor pore. Nature. 2003, s. 949–955. DOI 10.1038/nature01748. PMID 12827192.
- ↑ Akabas M.H.; STAUFFER D.A.; XU M.; KARLIN A. Acetylcholine receptor channel structure probed in cysteine-substitution mutants. Science. 1992, s. 307–310. DOI 10.1126/science.1384130. PMID 1384130.
- ↑ King N, Hittinger CT, Carroll SB. Evolution of key cell signaling and adhesion protein families predates animal origins. Science. 2003, s. 361–3. DOI 10.1126/science.1083853. PMID 12869759.
- ↑ FILMORE, David. It's a GPCR world. Modern Drug Discovery. American Chemical Society, 2004, s. 24–28. Dostupné online.
- ↑ Gilman A.G. G Proteins: Transducers of Receptor-Generated Signals. Annual Review of Biochemistry. 1987, s. 615–649. DOI 10.1146/annurev.bi.56.070187.003151. PMID 3113327.
- ↑ Müller-Pillascha F.; WALLRAPPA C.; LACHERA U.; FRIESSB H.; BÜCHLERB M.; ADLERA G.; GRESS T. M. Identification of a new tumour-associated antigen TM4SF5 and its expression in human cancer. Gene. 1998, s. 25–30. DOI 10.1016/S0378-1119(97)00633-1. PMID 9479038.
- ↑ Scheuer K.; MARASB A.; GATTAZB W.F.; CAIRNSC N.; FÖRSTLB H.; MÜLLER W.E. Cortical NMDA Receptor Properties and Membrane Fluidity Are Altered in Alzheimer's Disease. Dementia. 1996, s. 210–214. DOI 10.1159/000106881. PMID 8835885.
- ↑ Wang R.; GAO Y.; LAI L. LigBuilder: A Multi-Purpose Program for Structure-Based Drug Design. Journal of Molecular Modeling. 2000, s. 498–516. DOI 10.1007/s0089400060498.
- ↑ Schneider G.; FECHNER U. Computer-based de novo design of drug-like molecules. Nature Reviews Drug Discovery. 2005, s. 649–663. DOI 10.1038/nrd1799. PMID 16056391.
- ↑ Jorgensen W.L. The Many Roles of Computation in Drug Discovery. Science. 2004, s. 1813–1818. DOI 10.1126/science.1096361. PMID 15031495.
