Trikarbonyl (benzylidenaceton)železa
| Trikarbonyl (benzylidenaceton)železa | |
|---|---|
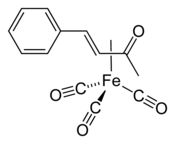 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | trikarbonyl (benzylidenaceton)železa |
| Sumární vzorec | C13H10FeO4 |
| Vzhled | červená pevná látka |
| Identifikace | |
| Registrační číslo CAS | 38333-35-6 |
| PubChem | 11403415 |
| SMILES | [Fe].[O+]#[C-].[O+]#[C-].[O+]#[C-].O=C(\C=C\c1ccccc1)C |
| InChI | InChI=1S/C10H10O.3CO.Fe/c1-9(11)7-8-10-5-3-2-4-6-10;3*1-2;/h2-8H,1H3;;;;/b8-7+;;;; |
| Vlastnosti | |
| Molární hmotnost | 286,06 g/mol |
| Teplota tání | 88 až 89 °C (361 až 362 K) |
| Rozpustnost ve vodě | málo rozpustný |
Některá data mohou pocházet z datové položky. | |
Trikarbonyl (benzylidenaceton)železa (zkráceně (bda)Fe(CO)3) je organická sloučenina se vzorcem (C6H5CH=CHC(O)CH3)Fe(CO)3. Používá se jako přenašeč Fe(CO)3.[1]
Struktura
[editovat | editovat zdroj](bda)Fe(CO)3 je komplex η2-ketonu. V infračerveném spektru má (v cyklohexanovém roztoku) absorpční pásy 2065, 2005 a 1985 cm−1, tři pásy naznačují nízkou symetrii tohoto chirálního komplexu.
Příprava, reakce a podobné sloučeniny
[editovat | editovat zdroj]
Trikarbonyl (benzylidenaceton)železa se připravuje reakcí nonakarbonylu diželeza (Fe2(CO)9) s benzylidenacetonem.[2]
(bda)Fe(CO)3 reaguje s Lewisovými zásadami za vzniku aduktů, aniž by došlo k oddělení benzylidenacetonu (bda).[3]
Jako zdroj Fe(CO)3 se také používá Fe2(CO)9 nebo Fe(CO)3(cyklookten)2, který je vysoce reaktivní, ovšem nestálý za vyšších teplot. Iminové deriváty cinnamaldehydu, například C6H5CH=CHC(H)=NC6H5, také vytvářejí s Fe(CO)3 reaktivní adukty, jež mohou být v některých oblastech vhodnější než (bda)Fe(CO)3.[4]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku (Benzylideneacetone)iron tricarbonyl na anglické Wikipedii.
- ↑ Knölker, H.-J. "(η4-Benzylideneacetone)tricarbonyliron" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289X.
- ↑ A. J. P. Domingos; J. A. S. Howell; B. F. G. Johnson; J. Lewis. Reagents for the Synthesis of η-Diene Complexes of Tricarbonnyliron and Tricarbonylruthenium. Inorganic Syntheses. 1990, s. 52–55. doi:10.1002/9780470132593.ch11.
- ↑ J. A. S. Howell; J. C. Kola; D. T. Dixon; P. M. Burkinshaw; M. J. Dixon. The kinetics and mechanism of diene exchange in (η4-enone)Fe(CO)2L complexes (L = phosphine, phosphite). Journal of Organometallic Chemistry. 1984, s. 83–96. doi:10.1016/0022-328X(84)80113-8.
- ↑ Knölker, H.-J.; Braier, A.; Bröcher, D. J.; Cämmerer, S. Fröhner, W.; Gonser, P.; Hermann, H.; Herzberg, D.; Reddy, K. R.; Rohde, G. “Recent applications of tricarbonyliron-diene complexes to organic synthesis” Pure and Applied Chemistry 2001, Volume 73, pp. 1075–1086. doi:10.1351/pac200173071075
Literatura
[editovat | editovat zdroj]- Alcock, N. W.; Richards, C. J.; Thomas, S. E. Preparation of Tricarbonyl(η4-vinylketene)iron(0) Complexes from Tricarbonyl(ε4-vinyl ketone)iron(0) Complexes and Their Subsequent Conversion to Tricarbonyl(ε4-vinylketenimine)iron(0) Complexes. Organometallics. 1991, s. 231–238. doi:10.1021/om00047a054.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Trikarbonyl (benzylidenaceton)železa na Wikimedia Commons
Obrázky, zvuky či videa k tématu Trikarbonyl (benzylidenaceton)železa na Wikimedia Commons
