Trans efekt
Jako trans efekt se v anorganické chemii označuje vlastnost ligandů, které jsou v konfiguraci trans reaktivnější než některé jiné ligandy. Bývá přičítán elektronovým efektům a nejlépe je popsán u čtvercových rovinných komplexních sloučenin, byl však pozorován i u oktaedrických komplexů.[1] Obdobným jevem je cis efekt u karbonylových komplexů, jenž se ovšem nejčastěji vyskytuje u oktaedrických komplexů přechodných kovů.
Kromě tohoto kinetického trans efektu mají trans ligandy také vliv na základní stavy molekul, například na délku a stabilitu vazeb. Někdy se pro tento jev používá označení trans vliv, aby byl odlišen od kinetického efektu,[2] zatímco jindy se popisuje jako strukturní trans efekt nebo termodynamický trans efekt.[1]
Kinetický trans efekt
[editovat | editovat zdroj]Intenzita trans efektu (měřená jako nárůst rychlosti substituce u trans ligandu) roste v následující řadě:
- F−, H2O, OH− < NH3 < py < Cl− < Br− < I−, SCN−, NO −
2 , SC(NH2)2, Ph− < SO 2−
3 < PR3, AsR3, SR2, CH3− < H−, NO, CO, CN−, C2H4
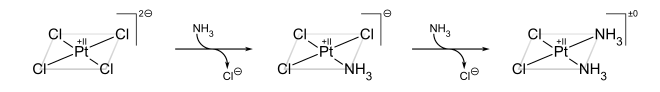
Příkladem trans efektu je příprava cisplatiny a transplatiny.[3]
Výchozím materiálem je PtCl42−, první NH3 ligand se na čtyři ekvivalentní pozice váže náhodně; vzhledem k tomu, že Cl− má silnější trans efekt než NH3, tak se druhý NH3 naváže do polohy trans vůči Cl− a tedy cis oproti prvnímu NH3.
Pokud by se začalo u Pt(NH3)42+, tak by vznikal trans produkt:
Trans efekt u čtvercových komplexů lze vysvětlit pomocí adičně/eliminačního mechanismu, jehož meziproduktem je trigonální bipyramida. Ligandy se silnějším trans efektem obecně mají vysokou π kyselost (například fosfiny) nebo slabé odpudivé síly mezi volným elektronovým párem a dπ elektrony (což jsou mimo jiné hydridy), které upřednostňují u meziproduktu více π-zásaditá místa. Druhá ekvatoriální pozice je obsazena přicházejícím ligandem; podle principu mikroskopické vratnosti se musí odcházející ligand také odštěpit z ekvatoriální pozice. Třetí, a tedy poslední, zaujímá trans ligand, takže kineticky výhodným produktem je ten, u kterého se odštěpuje ligand v poloze trans oproti tomu, jenž má nejvýraznější trans efekt.[2]
Strukturní trans efekt
[editovat | editovat zdroj]Strukturní trans efekt lze experimentálně naměřit pomocí rentgenové krystalografie a pozorovat se dá jako prodloužení vazby mezi kovem a ligandem v poloze trans vůči ligandu vykazujícímu trans efekt. Vazba může být u ligandů se silným trans vlivem, jako je hydrid, až o 2 pm delší. Lze též pozorovat cis vliv, který je však slabší než trans. Relativní intenzita cis a trans efektů je závislá na formální elektronové konfiguraci kovového centra; byla přitom navržena vysvětlení založená na atomových orbitalech.[4]
Odkazy
[editovat | editovat zdroj]Literatura
[editovat | editovat zdroj]- Quagliano, J. V.; Schubert, Leo. The Trans Effect in Complex Inorganic Compounds. Chem. Rev. 1952, 50, 201-260. DOI:10.1021/cr60156a001
- Basolo, F.; Pearson, R. G. The trans effect in metal complexes. Prog. Inorg. Chem. 1962, 4, 381-453.
- Hartley, F. R. The cis- and trans-effects of ligands. Chem. Soc. Rev. 1973, 2, 163-179. DOI:10.1039/CS9730200163
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Trans efekt na Wikimedia Commons
Obrázky, zvuky či videa k tématu Trans efekt na Wikimedia Commons
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Trans effect na anglické Wikipedii.
- ↑ a b COE, Benjamin J; GLENWRIGHT, Susan J. Trans-effects in octahedral transition metal complexes. Coordination Chemistry Reviews. 2000-06, roč. 203, čís. 1, s. 5–80. Dostupné online [cit. 2021-11-28]. DOI 10.1016/S0010-8545(99)00184-8. (anglicky)
- ↑ a b Robert H. Crabtree. The Organometallic Chemistry of the Transition Metals. New Jersey: Wiley-Interscience, 2005. Dostupné online. ISBN 0-471-66256-9.
- ↑ George B. Kauffman; Dwaine O. Cowan. cis- and trans-Dichlorodiammineplatinum(II). Inorganic Syntheses. S. 239–245. DOI 10.1002/9780470132388.ch63.
- ↑ Anderson, K. M.; Orpen, A. G. On the relative magnitudes of the cis and trans influences in metal complexes. Chem. Commun. 2001, 2682-2683. DOI:10.1039/b108517b