Topicita
Pojem topicita označuje stereochemické souvislosti mezi substituenty a strukturou molekul, na které jsou navázány. Podle druhů těchto vztahů se funkční skupiny označují jako heterotopní, homotopní, enantiotopní, či diastereotopní.
Homotopní skupiny
[editovat | editovat zdroj]Homotopní skupiny jsou navzájem ekvivalentní. Dvojice skupin A a B je homotopní, pokud molekula po výměně skupiny za jiný atom (například brom) a zachování podoby zbytku molekuly zůstává nechirální; identičnost homotopních skupin zůstává zachována ve všech prostředích. Homotopní NMR-aktivní jádra mají v NMR spektrech shodné chemické posuny. Jako příklad může sloužit molekula methanu (CH4), kde jsou čtyři atomy vodíku navzájem homotopní, podobně jako dvojice vodíkových a dvojice chlorových atomů u dichlormethanu (CH2Cl2).
Enantiotopní skupiny
[editovat | editovat zdroj]Jako enantiotopní se označují dvě skupiny v molekule, pokud by při nahrazení jedné z nich vznikla chirální molekula. Dvě varianty, které by takto mohly vzniknout, jsou navzájem enantiomery.
Enantiotopní jsou například dva atomy vodíku na druhém uhlíkovém atomu butanu. Nahrazením jednoho vodíku (znázorněného modře) bromem vznikne (2R)-2-brombutan. Nahrazením druhého (červeně) bromem by se vytvořil (2S)-2-brombutan.
 |
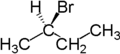 |

|
| butan | (2R)-2-brombutan | (2S)-2-brombutan |
Enantiotopní skupiny se od sebe dají odlišit v chirálních prostředích; například vodíky CH2 skupiny ethanolu (CH3CH2OH) jsou obvykle enantiotopní, ale mohou být odlišné (diastereotopní), pokud se na molekule vytvoří chirální centrum; to je možné provést například přeměnou na ester chirální karboxylové kyseliny, jako je kyselina mléčná, navázáním na chirální kovové centrum, nebo na aktivní místo enzymu (protože enzymy se skládají z chirálních aminokyselin); působením enzymu alkoholdehydrogenázy se ze skupiny CH2 při oxidaci ethanolu na acetaldehyd odštěpuje jeden konkrétní vodík, který je při zpětné reakci nahrazován na stejném místě. K dosažení tohoto účinku nemusí být chirální prostředí enantiomerně čisté.
Enantiotopní skupiny jsou navzájem zrcadlovými obrazy podle vnitřní roviny souměrnosti, chirální prostředí je této souměrnosti zbavuje. Enantiotopní páry NMR-aktivních jader jsou od sebe, podobně jako u homotopních, nerozlišitelné pomocí NMR a vytvářejí jediný signál.
Skupiny, které jsou vůči sobě enantiotopní, nemusí být navázány na stejný atom; například dva vodíky sousedící s karbonylovou skupinou cis-2,6-dimethylcyklohexanonu jsou enantiotopní, jejich vnitřní rovina souměrnosti prochází karbonylovou skupinou, deprotonace na dvou různých stranách od karbonylu vytvoří dva různé enantiomery, podobně jako nahrazení jednoho nebo druhého vodíku deuteriem.
Diastereotopní skupiny
[editovat | editovat zdroj]Diastereotopní skupiny jsou takové, po jejichž nahrazení by se utvořil diastereomer. Diastereotopní skupiny jsou často, ale ne vždy, shodné skupiny navázané na stejný atom, v molekule obsahující alespoň jedno chirální centrum.
Jako příklad lze uvést dvojici atomů vodíku v CH2 skupině (2S)-2-brombutanu. Nahrazením jednoho vodíku (znázorněného modře) bromem vznikne (2S,3R)-2,3-dibrombutan a nahrazením druhého vodíku (znázorněného červeně)bromem se vytvoří diastereomer (2S,3S)-2,3-dibrombutan.
 |
 |
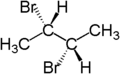
|
| (2S)-2-brombutan | (2S,3R)-2,3-dibrombutan | (2S,3S)-2,3-dibrombutan |
U chirálních molekul obsahující diastereotopní skupiny, jako je 2-brombutan, není nutná enantiomerní čistota, protože každý enantiomer vytvoří substitucí diastereotopních skupin stejné enantiomery (meso izomery přísně vzato nevytváří žádné enantiomery).
Diastereotopní skupiny nejsou navzájem zrcadlovými obrazy podle žádné roviny, jsou vždy odlišné, ale nemusí být rozlišitelné; například oba páry vodíků v CH2 u hydrochloridu ethylfenylalaninátu (PhCH2CH(NH3+)COOCH2CH3 Cl−) jsou diastereotopiní a oba vytváří páry odlišných 1H-NMR signálů v DMSO-d6 na 300 MHz,[1] ale u podobného ethyl-2-nitrobutanoátu (CH3CH2CH(NO2)COOCH2CH3) v CDCl3 dává odlišné signály pouze CH2 vedle chirálního centra[2] Tyto signály jsou často složité, protože se se v nich objevují odchylky chemických posunů, překryvy, a další silné interakce geminálních vodíků. Dvojice CH3 skupin ipsenolu, vzdálených od chirálního centra o tři vazby, dává v 1H při 300 MHz odlišné dublety a oddělené signály při 13C-NMR v CDCl3,[3] ale diastereotopní vodíky ethylalanináthydrochloridu (CH3CH(NH3+)COOCH2CH3 Cl−), také vzdálené od chirálního centra o tři vazby, mají 1H-NMR signály v DMSO-d6 obtížně rozlišitelné.[4]

Diastereotopní skupiny se mohou vyskytovat i v nechirálních molekulách; například je diastereotopní každý CH2 vodík v pentan-3-olu, protože CH2 uhlíky jsou enantiotopní. Substitucí kteréhokoliv ze čtyř CH2 vodíku vzniknou dvě nová chirální centra, a produkty substituce na libovolném CH2 uhlíku budou diastereomery. Tento druh topicity se obvykle snadněji detekuje u cyklických sloučenin, například jakýkoliv pár CH2 vodíků cyklopentanolu je podobně diastereotopní, a lze he snadno odlišit, jelikož jeden je vůči skupině OH v poloze cis a druhý v poloze trans.
Jako diastereotopní se také označují shodné skupiny navázané na tentýž konec alkenové skupiny, které po nahrazení vytvoří geometrické izomery (které též patří mezi diastereomery), jako například CH2 vodíky propenu, kde je jeden cis a ostatní jsou trans vůči methylové skupině, a záměnou jednoho z nich za CH3 by vznikl cis- nebo trans-but-2-en.

Diastereotopicita se může vyskytovat i u anorganických sloučenin a skupin, navázaných na atomy jiných prvků než uhlíku, příslušné molekuly ani nemusí mít chirální tetraedrální (sp3-hybridizovaná) centra; například dvojice vodíků v libovolné CH2 nebo NH2 skupině tris(ethylendiamin)chromitého iontu (Cr(en)33+), kde je kovové centrum chirální, rovněž vykazují diastereotopicitu.
Enantiotopicita a diastereotopicita se také uplatňuje u rovinných skupin (obvykle karbonylových a alkenových).
Heterotopicita
[editovat | editovat zdroj]Heterotopní jsou skupiny se strukturně odlišnými substituenty, nejsou diastereotopní, enantiotopní, ani homotopní.[5]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Topicity na anglické Wikipedii.
- ↑ 300 MHz 1H-NMR spectrum of ethyl phenylalaninate hydrochloride in DMSO-d6 from Sigma-Aldrich Co.
- ↑ 300 MHz 1H-NMR spectrum of ethyl 2-nitrobutanoate in CDCl3 Sigma-Aldrich
- ↑ Silverstein, R. et al.: Spectrometric Identification of Organic Compounds, 7th ed., John Wiley & Sons, 2005
- ↑ 300 MHz 1H-NMR spectrum of ethyl alaninate hydrochloride in DMSO-d6 from Sigma-Aldrich
- ↑ Hans J. Reich. Symmetry in NMR Spectra [online]. University of Wisconsin. Dostupné online.
