Pyrazin
| Pyrazin | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1,4-diazabenzen |
| Sumární vzorec | C4H4N2 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 290-37-9 |
| EC-no (EINECS/ELINCS/NLP) | 206-027-6 |
| PubChem | 9261 |
| ChEBI | 30953 |
| SMILES | C1=CN=CC=N1 |
| InChI | InChI=1S/C4H4N2/c1-2-6-4-3-5-1/h1-4H |
| Vlastnosti | |
| Molární hmotnost | 80,088 g/mol |
| Teplota tání | 54 °C (327 K)[1] |
| Teplota varu | 115 °C (388 K)[1] |
| Hustota | 1,031 g/cm3 |
| Rozpustnost ve vodě | rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H228 H315 H319 H335[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264+265 P271 P280 P302+352 P303+361+353 P304+340 P305+351+338 P319 P321 P331+317 P337+317 P362+364 P370+378 P403+233 P403+235 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Pyrazin je aromatická heterocyklická sloučenina se vzorcem C4H4N2, strukturní izomer pyridazinu a pyrimidinu. Je slabší zásadou než pyridin, pyridazin, i pyrimidin.[2]
Pyrazin a jeho alkylované deriváty se vyskytují jako příchutě a vůně v pečivu a pražených potravinách. Tetramethylpyrazin (nazývaný také ligustrazin) zachycuje superoxidové anionty a omezuje tvorbu oxidu dusnatého v lidských granulocytech.[3]
Příprava a výroba
[editovat | editovat zdroj]Pyrazin a jeho deriváty lze získat mnoha různými postupy; některé z nich patří k nejstarším dosud využívaným syntetickým reakcím.
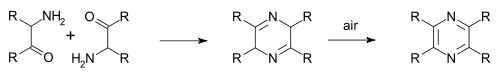
Staedelova–Rugheimerova syntéza pyrazinů (objevená v roce 1876) využívá reakci 2-chloracetofenonu s amoniakem a oxidaci vznikého aminoketonu na pyrazin.[4] Samokondenzace je také součástí Gutknechtovy syntézy pyrazinů (1879), ale liší se způsobem tvorby alfa-ketoaminu.[5][6]
Další možnost představuje Gastaldiho syntéza.[7][8]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Pyrazine na anglické Wikipedii.
- ↑ a b c d e f g h https://pubchem.ncbi.nlm.nih.gov/compound/9261
- ↑ Pyrazine C4H4N2 [online]. ChemSpider [cit. 2022-01-04]. Dostupné online.
- ↑ Zhaohui Zhang; Taotao Wei; Jingwu Hou; Gengshan Li; Shaozu Yu; Wenjuan Xin. Tetramethylpyrazine scavenges superoxide anion and decreases nitric oxide production in human polymorphonuclear leukocytes. Life Sciences. 2003, s. 2465–2472. DOI 10.1016/S0024-3205(03)00139-5. PMID 12650854.
- ↑ Ueber die Einwirkung von Ammoniak auf Chloracetylbenzol W. Staedel, L. Rügheimer doi:10.1002/cber.187600901174 Berichte der deutschen chemischen Gesellschaft pp. 563–564, 1876
- ↑ Mittheilungen Ueber Nitrosoäthylmethylketon H. Gutknecht Berichte der deutschen chemischen Gesellschaft, pp. 2290–2292, 1879 doi:10.1002/cber.187901202284
- ↑ Heterocyclic chemistry T. L. Gilchrist ISBN 0-582-01421-2
- ↑ G. Gastaldi, Gazzetta Chimica Italiana 51, (1921) 233
- ↑ Amines: Synthesis, Properties and Applications Stephen A. Lawrence 2004 Cambridge University Press ISBN 0-521-78284-8
Související články
[editovat | editovat zdroj]- Alkylpyraziny
- Methoxypyraziny
- Benzen
- Pyridazin
- Pyridin
- Pyrimidin
- Piperazin, nasycený analog