Nukleofilní aromatická substituce

Nukleofilní aromatická substituce je substituční reakce v organické chemii, při které nukleofil nahrazuje jinou skupinu navázanou na aromatické jádro. Může probíhat šesti různými mechanismy, mezi které patří
- SNAr (adiční-eliminační) mechanismus
- aromatický SN1 mechanismus s diazoniovými solemi
Nejvýznamnější z nich je SNAr mechanismus, při němž skupina odtahující elektrony aktivuje jádro vůči nukleofilním atakům.
SNAr mechanismus
[editovat | editovat zdroj]Dále je popsán mechanismus nukleofilní aromatické substituce 2,4-dinitrochlorbenzenu v zásaditém vodném roztoku.

Uhlíkový atom, na který je navázán chlor, se označuje číslem 1 a ostatní čísly 2 až 6 po směru hodinových ručiček. Jelikož je nitroskupina vůči nukleofilní substituci aktivující skupinou usměrňuje substituci do polohy meta, tak uhlíkovému atomu benzenového kruhu, na který je navázána, dodává záporný náboj. V Meisenheimerově komplexu se nevazebné elektrony karboaniontu navážou na aromatický π systém, čímž umožní připojení hydroxylu na ipso uhlík. Takto vytvořený meziprodukt se odštěpením hydroxylové skupiny nebo chloridu dostane na nižší energetickou hladinu; v roztoku probíhají oba tyto děje, přičemž malá část odštěpí chlorid za vzniku konečného produktu (2,4-dinitrofenolu), zatímco zbytek odštěpí hydroxyl, čímž dojde k obnovení reaktantu. 2,4-dinitrofenol má nižší potenciální energii než reaktant, a tak se po určité době vytvoří rovnovážný stav s převahou 2,4-dinitrofenolu.
Vznik rezonančně stabilizovaného Meisenheimerova komplexu je pomalý, protože má tento komplex vyšší energii než reaktant. Odštěpení chloridu probíhá rychle, protože se cyklus opět stává aromatickým. Ukazuje se ovšem, že v některých případech není meziproduktem Meisenheimerův komplex, ale meziprodukt „předního SN2 procesu“.[1]
U arylhalogenidů nemůže proběhnout klasická SN2 reakce. Vazba uhlík-halogen se nachází v rovině aromatického jádra, protože uhlíkový atom má rovinnou trojúhelníkovou geometrii. Atak uhlíku ze zadní strany je tím znemožněn a k takovéto reakci tedy nemůže dojít.[2] SN1 reakce nastat může, ale je velmi nepravděpodobná, protože by vedla k energeticky nevýhodnému oddělení odcházející skupiny a tvorbě arylového kationtu.[2] Aktivující skupinou je při nukleofilní aromatické substituci nejčastěji nitroskupina, může to být také například kyano- nabo acylová skupina.[3] Odcházející skupinou může být halogen nebo sulfid. S rostoucí elektronegativitou se rychlost nukleofilních ataků zvyšuje,[3] a to díky tomu, že krokem určujícím rychlost reakce je zde nukleofilní atak a následný zánik aromaticity. Schopnost halogenů podstoupit SNAr reakci klesá v řadě F > Cl ≈ Br > I, tedy obráceně oproti SN2 reakci, což se může jevit jako zvláštní,m jelikož vazba C-F patří v organické chemii k nejsilnějším. Díky její značné polaritě je ovšem fluorid při SNAr reakci ideální odcházející skupinou. Nukleofily mohou být aminy, alkoxidy, thioethery a stabilizované karboanionty.[3]
Příklady
[editovat | editovat zdroj]K typickým nukleofilním substitučním reakcím arenů patří:
- Bambergerův přesmyk, kdy se N-fenylhydroxylaminy přeměňují na 4-aminofenoly. Nukleofilem je voda.
- Sandmeyerova a Gattermannova reakce, při kterých diazoniové soli reagují s halogenidy.
- Smilesův přesmyk, jenž je vnitromolekulární obdobou této reakce.
U heteroarenů probíhá nukleofilní aromatická substituce snadněji než u arenů. Pyridiny jsou obzvlášť reaktivní, pokud jsou substituovány v poloze orto nebo para, protože pak je záporný náboj ideálně delokalizován na dusíku. Příkladem takové reakce je Čičibabinova reakce, při níž pyridin reaguje s amidem alkalického kovu, jako je amid sodný, za vzniku 2-aminopyridinu.[4]
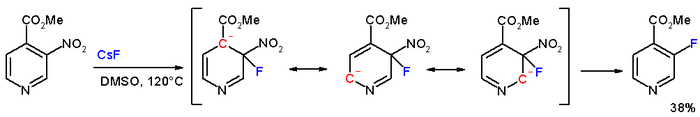
U methyl-3-nitropyridin-4-karboxylátu lze nitroskupinu v poloze meta snadno nahradit fluorem reakcí s fluoridem cesným v dimethylsulfoxidu (DMSO) při 120 °C.[5]
Asymetrická nukleofilní aromatická substituce
[editovat | editovat zdroj]S nukleofily jako jsou 1,3-dikarbonylové sloučeniny, lze provést asymetrickou syntézu chirálních sloučenin pomocí nukleofilní aromatické substituce.[6] Katalyzátorem je derivát cinchonidinu, který má na dusíku a kyslíku připojené benzylové skupiny.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Nucleophilic aromatic substitution na anglické Wikipedii.
- ↑ Tobias Ritter; Jacob Hooker; Constanze N. Neumann. Concerted nucleophilic aromatic substitution with 19F− and 18F−. Nature. 2016, s. 369–373. ISSN 1476-4687. PMID 27281221.
- ↑ a b Organic Chemistry J. Clayden , Oxford University Press
- ↑ a b c Nucleophilic Aromatic Substitution—Addition and Identification of an Amine Steven W. Goldstein, Ashley Bill, Jyothi Dhuguru, and Ola Ghoneim Journal of Chemical Education Article ASAP doi:10.1021/acs.jchemed.6b00680
- ↑ Advanced organic Chemistry, Reactions, mechanisms and structure 3ed. Jerry March ISBN 0-471-85472-7
- ↑ A Simple Synthetic Route to Methyl 3-Fluoropyridine-4-carboxylate by Nucleophilic Aromatic Substitution Freddy Tjosaas and Anne Fiksdahl Molecules 2006, 11, 130–33 Article
- ↑ Organocatalytic Regio- and Asymmetric C-Selective SNAr Reactions-Stereoselective Synthesis of Optically Active Spiro-pyrrolidone-3,3'-oxoindoles Marco Bella, Sara Kobbelgaard, and Karl Anker Jrgensen Journal of the American Chemical Society; 2005; 127(11) pp 3670–71; (Communication) doi:10.1021/ja050200g
Související články
[editovat | editovat zdroj]- Elektrofilní aromatická substituce
- Nukleofil
- Substituční reakce
- SN1 reakce
- SN2 reakce
- Nukleofilní acylová substituce
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Nukleofilní aromatická substituce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Nukleofilní aromatická substituce na Wikimedia Commons




