Izoforon
| Izoforon | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | 3,5,5-trimethylcyklohex-2-en-1-on |
| Ostatní názvy | izoacetoforon |
| Anglický název | Isophorone |
| Sumární vzorec | C9H14O |
| Vzhled | bezbartvá až nažloutlá kapalina |
| Identifikace | |
| Registrační číslo CAS | 78-59-1 |
| PubChem | 6544 |
| SMILES | O=C1\C=C(/CC(C)(C)C1)C |
| InChI | InChI=1/C9H14O/c1-7-4-8(10)6-9(2,3)5-7/h4H,5-6H2,1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 138,207 g/mol |
| Teplota tání | −8,1 °C (265,0 K) |
| Teplota varu | 215,32 °C (488,47 K) |
| Hustota | 0,9255 g/cm3 |
| Dynamický viskozitní koeficient | 2,62 cP |
| Index lomu | 1,4766 |
| Rozpustnost ve vodě | 1,2 g/100 ml |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a ethanolu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu, diethyletheru, hexanu, dichlormethanu a toluenu |
| Tlak páry | 40 Pa (20 °C) |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 43,4 kJ/mol |
| Bezpečnost | |
| [1] Varování[1] | |
| Teplota vzplanutí | 84 °C (357 K) |
| Teplota vznícení | 460 °C (733 K) |
| Meze výbušnosti | 0,8-3,8 % |
Některá data mohou pocházet z datové položky. | |
Izoforon je α,β-nenasycený keton, bezbarvá až nažloutlá kapalina s vůní připomínající mátu. Používá se jako rozpouštědlo a jako surovina v organické syntéze.
Reaktivita
[editovat | editovat zdroj]Izoforon může být degradován reakcí s hydroxylovými radikály vytvořenými fotochemicky. Poločas této reakce je kolem pěti hodin.[2]
Tato látka reaguje se silnými oxidačními činidly, silnými zásadami a aminy.
Výroba
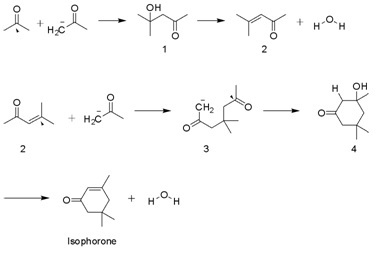
[editovat | editovat zdroj]Izoforon se v přírodě nevyskytuje, na jeho výrobu bylo vyvinuto několik postupů. Nejčastěji používaná metoda zahrnuje autokondenzaci acetonu s KOH. Dehydrogenovaný aceton umožňuje uhlíkovým atomům na jedné molekule atakovat centrální (tedy karbonylový) uhlík druhé molekuly acetonu. Při této reakci vzniká diacetonalkohol (4-hydroxy-4-methylpentan-2-on)(1), jeho dehydratací se tvoří mesityloxid(2) a voda jako vedlejší produkt. Dehydrogenovaný aceton poté může dále v Michaelově reakci reagovat s mesityloxidem na 4,4-dimethyl-2,6-dioxoheptan-1-id (3), který atakuje vlastní karbonylový uhlík za vzniku 3-hydroxy-3,5,5-trimethylcyclohexan-1-onu (4). Dehydratací tohoto produktu se nakonec utvoří izoforon.
Jako katalyzátor se, má-li být vzniklý izoforon v kapalném skupenství, většinou používá jako katalyzátor smíšený oxid Mg1-xAlxO1+x. Pro syntézu izoforonu ve formě par je potřeba, aby autokondenzace acetonu proběhla při teplotě vyšší než 200 °C.[3]
Použití
[editovat | editovat zdroj]Izoforon se používá jako rozpouštědlo v některých tiskařských inkoustech, barvách, lacích, lepidlech, kopolymerech, nátěrech a pesticidech[4], také jako meziprodukt v organické syntéze, složka podlahových tmelů a přípravků na konzervaci dřeva.
Historie
[editovat | editovat zdroj]Používání izoforonu jako rozpouštědla vyplynulo z výzkumu způsobů, jak likvidovat nebo recyklovat aceton, který je odpadním produktem při syntéze fenolu přes kumen.[5]
Izomery
[editovat | editovat zdroj]
Hlavním vedlejším produktem při vzniku izoforomu (někdy zvaného α-izoforon) je β-izoforon (3,5,5-trimethylcyclohex-3-en-1-on).
Metabolismus
[editovat | editovat zdroj]Izoforonu se lze vystavit třemi způsoby: vdechnutím, vstřebáním kůží a vypitím vody, která obsahuje tuto látku.
Těmito třemi způsoby může izoforon proniknout epitelovými tkáněmi, poté se stává toxickým.
Izoforon je dobře absorbován a je rozpustný ve vodě.[6] Díky tomu jej nejpravděpodobněji lze nalézt v moči. Tyto údaje byly získány ze studií na krysách.
Téměř 93 % izoforonu, který se do těla dostane ústní dutinou, je během 24 hodin vyloučeno v nezměněné podobě, převážně močí a vydechovaným vzduchem. Distribuce izoforonu v organismu byla měřena pomocí radioaktivního značkování 14C, izotopu, který je dobře přijímán všemi tkáněmi. Nejvyšší koncentrace po 24 hodinách byly nalezeny v játrech, ledvinách a v předkožkových žlázách.[7]
Moč také obsahovala tyto deriváty izoforonu:
- 3-karboxy-5[ujasnit] (vzniká methyloxidací)
- 5-dimethyl-2-cyklohexen-1-on (methyloxidace)
Toxicita
[editovat | editovat zdroj]Dobrovolníci, kteří bylo vystaveni izoforonu o koncentracích 40, 80, 200 a 400 ppm pocítili dráždění v nosu, krku a na očích. Lidské oči jsou drážděny už při koncentraci 25 ppm. Silnější dráždění očí a nosu nastalo při 200 až 400 ppm.
Při dlouhodobém vystavení
[editovat | editovat zdroj]Dlouhodobé vystavení izoforonu způsobuje nevolnost, únavu a depresi. Studie na zvířatech ukázaly, že dlouhodobé vdechování izoforonu ovlivňuje centrální nervovou soustavu. Minimální jsou důkazy o vadách a zpomalení růstu plodu při expozici izoforonu v průběhu těhotenství. Informace o případné reprodukční či vývojové toxicitě nebo karcinogenitě izoforonu nejsou k dispozici.
Dle studie na USA a Švédsku vyšší hladiny isoforonu ve vzduchu vedou k více narozeným synům oproti dcerám[8].
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Isophorone na anglické Wikipedii.
- ↑ a b Isophorone. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ TOXNET [online]. [cit. 2016-03-11]. Dostupné online.
- ↑ TEISSIER, Remy; KERVENNAL, Jacques. Process for obtaining isophorone. [s.l.]: [s.n.], 15 Dec 1998. Dostupné online.
- ↑ Chronic Toxicity Summary. www.oehha.ca.gov [online]. [cit. 2017-10-23]. Dostupné v archivu pořízeném dne 2006-09-22.
- ↑ Isophorone history at Degussa
- ↑ QUINCY. National Fire Protection Association [online]. [cit. 2017-10-23]. Dostupné v archivu pořízeném dne 2017-07-13.
- ↑ ISOPHORONE - National Library of Medicine HSDB Database [online]. [cit. 2016-03-11]. Dostupné online.
- ↑ LONG, Yanan; CHEN, Qi; LARSSON, Henrik. Observable variations in human sex ratio at birth. PLOS Computational Biology. 2. 12. 2021, roč. 17, čís. 12, s. e1009586. Dostupné online [cit. 2021-12-03]. ISSN 1553-7358. DOI 10.1371/journal.pcbi.1009586. (anglicky)
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Izoforon na Wikimedia Commons
Obrázky, zvuky či videa k tématu Izoforon na Wikimedia Commons