Aromaticita
Vzhled
(přesměrováno z Hückelovo pravidlo)
Aromaticita a antiaromaticita jsou vlastnosti určující aromatické uhlovodíky (areny) a antiaromatické uhlovodíky. Jsou známy i aromatické heterocyklické sloučeniny.
Aromatické sloučeniny musí splňovat následující podmínky:
- planární (rovinná) cyklická molekula
- konjugovaný systém dvojných vazeb (mezomerní struktury)
- počet π-elektronů odpovídající Hückelovu pravidlu 4n+2, kde n ≥ 0.
Existují také velmi reaktivní antiaromatické sloučeniny. Splňují první dva body aromaticity, ale liší se v počtu π elektronů, který je roven 4n (všimněte si nepárových elektronů ve schématu molekulových orbitalů).
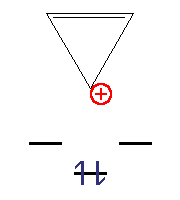
| Cyklopropen | Kation | Radikál | Anion |

|
|

|

|
| sp3 uhlík | 2 π elektrony; n=0 | 3 π elektrony | 4 π elektrony |
| Není aromatický | Je aromatický | Není aromatický | Je antiaromatický |

|

|

|

|
| 4 π elektrony | 2 π elektrony; n=0 | 6 π elektronů; n=1 | 4 π elektrony |
| Antiaromatický | Aromatický
(izoelektronický s cyklopropenovým aniontem) |
Aromatický
(izoelektronický s benzenem) |
Antiaromatický |

|

|

|

|
| 6 π elektronů; n=1 | 6 π elektronů; n=1 | 8 π elektronů | 8 π elektronů |
| Aromatický
(izoelektronický s benzenem) |
Aromatický
(izoelektronický s benzenem) |
Antiaromatický | Není aromatický
(není planární) |
| Cyklodekapentaen | Naftalen | Azulen |

|

|

|
| 10 π elektronů; n=2 | ||
| Není aromatický (sterické (prostorové) interakce mezi „vnitřními“ atomy H deformují planaritu) |
Aromatický | Aromatický (méně stálý než naftalen, při teplotě 350 °C v něj izomeruje) |
Literatura
[editovat | editovat zdroj]- Červinka O., Dědek V., Ferles M.: Organická chemie, druhé přepracované vydání, SNTL, Praha
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu aromaticita na Wikimedia Commons
Obrázky, zvuky či videa k tématu aromaticita na Wikimedia Commons
