Ethyl-acetát
| Ethyl-acetát | |
|---|---|
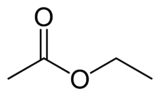 Strukturní vzorec ethyl-acetátu | |
 Model molekuly ethyl-acetátu | |
| Obecné | |
| Systematický název | ethyl-ethanoát |
| Triviální název | ethylester kyseliny octové |
| Ostatní názvy | ethyl-acetát, ethylacetát, ethylester ethanové kyseliny, ethylethanoát |
| Anglický název | Ethyl acetate |
| Německý název | Essigsäureethylester |
| Funkční vzorec | CH3COOCH2CH3 |
| Sumární vzorec | C4H8O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 141-78-6 |
| EC-no (EINECS/ELINCS/NLP) | 205-500-4 |
| Indexové číslo | 607-022-00-5 |
| SMILES | CCOC(C)=O |
| Číslo RTECS | AH5425000 |
| Vlastnosti | |
| Molární hmotnost | 88,105 g/mol |
| Teplota tání | −83,6 °C |
| Teplota varu | 77,1 °C |
| Hustota | 0,897 g/cm³ |
| Dynamický viskozitní koeficient | 0,426 cP (25 °C) |
| Index lomu | 1,372 0 |
| Rozpustnost ve vodě | 8,3 g/100 ml (20 °C) |
| Struktura | |
| Dipólový moment | 1,78 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 H319 H336 EUH066 |
| R-věty | R11 R36 R66 R67 |
| S-věty | (S2) S16 S26 S33 |
| NFPA 704 |  4
2
|
Některá data mohou pocházet z datové položky. | |
Ethyl-acetát nebo ethylester kyseliny octové, dříve zvaný i octan ethylnatý, je organická sloučenina s funkčním vzorcem CH3COOCH2CH3. Jedná se o ester ethanolu a kyseliny octové. Tato bezbarvá kapalina má charakteristickou sladkou vůní připomínající hrušky, ve kterých je obsažena. Vyrábí se ve velkém množství pro použití jako rozpouštědlo. V roce 1985 se v Japonsku, Severní Americe a Evropě dohromady ročně vyrobilo cca 400 tisíc tun[2], v roce 2004 se celosvětová výroba odhadovala na 1,3 milionu tun[3].
Výroba
[editovat | editovat zdroj]Kyselina octová reaguje s ethanolem za vzniku ethylacetátu a vody.
- CH3COOH + CH3CH2OH ⇌ CH3COOCH2CH3 + H2O
Výsledný produkt se musí odebírat, protože reakce je rovnovážná. Lze jej odebírat například destilací.
Použití
[editovat | editovat zdroj]Ethyl-acetát se primárně využívá jako rozpouštědlo a ředidlo, je upřednostňován díky nízké ceně, malé toxicitě a snesitelnému zápachu. Například se běžně používá pro čištění desek s elektronickými obvody a v některých odstraňovačích laku na nehty (používá se také aceton a acetonitril). Lze ho využít při dekofeinizaci kávových zrn a čajových lístků[4]. Používá se také v nátěrových hmotách jako aktivátor nebo tvrdidlo. Ethyl-acetát je přítomen v cukrovinkách, parfémech a v ovoci. V parfémech se rychle vypařuje a zanechává vůni parfému na kůži.
Laboratorní použití
[editovat | editovat zdroj]V laboratoři se směsi obsahující ethyl-acetát často používají ve sloupcové chromatografii a při extrakcích. Málokdy se však využívá jako reakční rozpouštědlo, protože je náchylný na hydrolýzu a transesterifikaci.
V organické chemii, zejména při experimentech, ho lze odstranit stlačeným vzduchem z horké vodní lázně, protože je velmi těkavý a má nízký bod varu.
Další použití
[editovat | editovat zdroj]V oblasti entomologie se ethyl-acetát využívá jako účinný asfyxant při sběru a studiu hmyzu. Ve smrtičce naplněné ethyl-acetátem jeho páry rychle usmrcují sbíraný (obvykle dospělý) hmyz, aniž by ho poškodily. Protože ethyl-acetát není hygroskopický, udržuje hmyz dostatečně měkký, aby mohl být přidán do sbírky.
Výskyt ve vínech
[editovat | editovat zdroj]Ethylester kyseliny octové je nejhojnějším esterem ve víně, tvoří se reakcí kyseliny octové a ethanolu během fermentace. Aroma ethyl-acetátu je nejvíce zřejmé v mladých vínech a přispívá k obecnému vnímání "ovocnosti" vína. Citlivost různých lidí se liší, většina má práh vnímání okolo 120 mg/l. Nadměrná množství ethyl-acetátu se považují za vadu vína. Expozice kyslíku může vadu zjitřit, protože dochází k oxidaci ethanolu na acetaldehyd, který zanechává ve víně ostrou octovou chuť[5].
Reakce
[editovat | editovat zdroj]Ethyl-acetát lze hydrolyzovat v kyselém nebo zásaditém prostředí a získat tak opět kyselinu octovou a ethanol. Použití kyselého katalyzátoru hydrolýzu urychluje (viz Fischerovo ekvilibrium). V laboratoři (a obvykle jen pro ilustrativní účely) se ethyl-acetát typicky hydrolyzuje ve dvoufázovém procesu, který začíná stechiometrickým množstvím silné zásady, například hydroxidu sodného. Tato reakce poskytuje ethanol a octan sodný, který s ethanolem nereaguje:
- Ethylacetát reaguje s hydroxidem sodným za vzniku ethanolu a octanu sodného.
Reaguje také s vodou:
- Ethylacetát reaguje s vodou za vzniku kyseliny octové a ethanolu.
Bezpečnost
[editovat | editovat zdroj]Smrtelná dávka LD50 u potkanů činí 11,3 g/kg, což svědčí o velmi nízké toxicitě[2].
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Ethyl acetate na anglické Wikipedii.
- ↑ a b Ethyl acetate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b Wilhelm Riemenschneider, Hermann M. Bolt "Esters, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI: 10.1002/14356007.a09_565.pub2. Article Online Posting Date: April 30, 2005
- ↑ DUTIA, Pankaj. Ethyl Acetate: A Techno-Commercial Profile. Chemical Weekly. August 10th, 2004, s. 184. Dostupné online [PDF, cit. 2009-03-21]. Archivováno 21. 8. 2018 na Wayback Machine.
- ↑ Folgers.com. www.folgers.com [online]. [cit. 2009-09-03]. Dostupné v archivu pořízeném z originálu.
- ↑ J. Robinson (ed) "The Oxford Companion to Wine" Third Edition pg 259 Oxford University Press 2006 ISBN 0-19-860990-6
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu ethyl-acetát na Wikimedia Commons
Obrázky, zvuky či videa k tématu ethyl-acetát na Wikimedia Commons




