Fluorid arsenitý
| Fluorid arsenitý | |
|---|---|
 3D model | |
 | |
| Obecné | |
| Systematický název | Fluorid arsenitý |
| Anglický název | Arsenic trifluoride |
| Německý název | Arsen(III)-fluorid |
| Sumární vzorec | AsF3 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 7784-35-2 |
| PubChem | 24571 |
| Číslo RTECS | CG5775000 |
| Vlastnosti | |
| Molární hmotnost | 131,916 8 g/mol |
| Teplota tání | −8,5 °C |
| Teplota varu | 63 °C |
| Hustota | 2,665 9 g/cm3 (0 °C) 2,449 7 g/cm3 (60 °C) |
| Rozpustnost ve vodě | Rozkládá se |
| Rozpustnost v polárních rozpouštědlech | methanol ethanol |
| Rozpustnost v nepolárních rozpouštědlech | diethylether aromatické uhlovodíky |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −821,3 kJ/mol |
| Standardní slučovací Gibbsova energie ΔGf° | −787 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R23/25, R50/53 |
| S-věty | (S1/2), S20/21, S28, S45, S60, S61 |
Některá data mohou pocházet z datové položky. | |
Fluorid arsenitý je chemická sloučenina arsenu a fluoru se vzorcem AsF3. Za normálních podmínek je to bezbarvá kapalina, která prudce reaguje s vodou.
Příprava a vlastnosti
[editovat | editovat zdroj]Může být připraven reakcí kyseliny fluorovodíkové a oxidu arsenitého:
- 6 HF + As2O3 → 2 AsF3 + 3 H2O
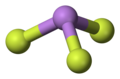
Má pyramidovou strukturu v plynném skupenství, která je také přítomna v skupenství pevném. V plynném skupenství je délka vazby As-F 170,6 pm a úhel vazby mezi F-As-F 96,2°.[2]
Fluorid arsenitý je používán k fluorování nekovových chloridů na fluoridy, díky tomu, že je méně reaktivní než fluorid antimonitý SbF3.
Draselná sůl KAs2F7 připravená z KF a AsF3 obsahuje ve své struktuře molekuly AsF4− a AsF3 a byla dokázáno, že molekula AsF3 interaguje s aniontem AsF4−.[3]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Arsenic trifluoride na anglické Wikipedii.
- ↑ a b Arsenic trifluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ Alkali-metal heptafluorodiarsenates(III): their preparation and the crystal structure of the potassium salt, Edwards A.J., Patel S.N., J. Chem. Soc., Dalton Trans., 1980, 1630-1632
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fluorid arsenitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid arsenitý na Wikimedia Commons


