Alotropy arsenu

Pevný arsen vytváří tři alotropy lišící se zbarvením: šedý, černý, a žlutý; tyto formy se liší také strukturou a reaktivitou, přičemž nejreaktivnější je žlutý arsen.
Šedý arsen
[editovat | editovat zdroj]
Šedý, též kovový, arsen, je za pokojové teploty nejstálejší, a je tak i nejrozšířenější formou.[1] Jedá se o křehkou ocelově šedě zbarvenou pevnou látku, která je dobrým elektrickým vodičem.[2]
Klencová struktura tohoto alotropu je podobná jako u černého fosforu. Jeho α-forma vytváří kruhy v židličkové konformaci ze šesti atomů arsenu, propojené do vrstev pkolmých ke krystalografické ose c. Vzdálenosti mezi sousedními As ve vrstvách jsou 251,7 pm wa jednotlivé vrstvy mají mezi sebou 312,0 pm. Celková struktura vykazuje narušenou osmistěnnou geometrii, v důsledku čehož má tento alotrop vlastnosti podobné kovům. Při 616 °C nastává sublimace, v plynném skupentsví se původní uspořádání ztrácí a vznikají drobné shluky As4, As2, a As, ve kterých převažuje As4.[1] Kondenzací těchto par na površích s teplotou pod 200 K se vytváří pevný žlutý arsen (As4), což je zapříčiněno nedostatkem energie pro tvorbu krystalů šedého arsenu; kondenzace za vyšších teplot vedou k amorfnímu černému arsenu - lze také izolovat krystalický černý arsen a amorfní formu je možné přeměnit na šedou. Šedý arsen je možné získat ze žlutého působením světla nebo návratem na pokojovou teplotu.[1]
Reakce
[editovat | editovat zdroj]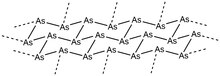
Šedý arsen je špatně rozpustný, a tak není známo mnoho jeho reakcí. Při vystavení vzduchu se přeměňuje na As2O3. Jsou také popsány jeho reakce s přechodnými kovy,[3][4] při těchto reakcích se odštěpuje oxid uhelnatý z cyklopentadienylových komplexů molybdenu, wolframu, a chromu a vytvořené meziprodukty reagují se šedým arsenem za vzniku molekul obsahujících jeden, dva, nebo tři atomy arsenu.

Černý arsen
[editovat | editovat zdroj]
Černý arsen (Asn) se připravuje ve dvou krocích; prvním je sublimace šedého arsenu a druhým následná kondenzace na zahřívaném povrchu; vzniklá struktura je arsenovým analogem červeného fosforu. Krystalický černý arsen zaujímá, pokud není dostatečně čistý, strukturu podobnou černému fosforu, s kosočtverečnými krystaly složenými z kruhů As6. Černáý arsen dosud nebyl připraven bez příměsí, jako jsou rtuť,[5] fosfor, a kyslík; čistý černý arsen byl ale nalezen v chilské provincii Copiapó. Zkoumáním minerálu arsenolampritu, nalezeného v místních jeskyních, byla zjištěna molekulová struktura se značnou anizotropií a polovodivost.Chybná citace: Chybí ukončovací </ref> k tagu <ref>
Group 8 and 9 metals
[editovat | editovat zdroj]
The metals of groups 8 and 9 feature the most extensive library of reactivity with yellow arsenic documented in the scientific literature, with particular focus on reactions of iron and cobalt complexes with As4. Much like the chromium and molybdenum sandwich complexes, (CpRFe(CO)2]2 complexes of iron react with yellow arsenic to produce analogous bimetallic products featuring "triple-decker" geometry. These reports also detail the isolation of a key intermediate, pentaarsaferrocene ([CpRFe(μ5-As5)]).[7] This intermediate, isolobal to ferrocene, replaces one of the cyclopentadienyl ligands with a cyclic As5 ligand that features As-As bond lengths of 2.312 Å (in line with delocalized As-As double bonds). This "sandwich-forming" reactivity can be meaningfully tuned by introducing bulkier ligands. Modifying the cyclopentadienyl groups with much bulkier derivatives produces a vastly different set of products. First, a butterfly complex with a central As4 unit is formed. Irradiation with light leads to further CO elimination and the formation of a bridged butterfly complex, which then rearranges into a unique complex featuring a central As8 moiety. This ligand, formally tetraanionic, forms an eight-membered ring bridging four iron atoms in total.[6]
Much of the same reactivity, including formation of butterfly and sandwich compounds, has been described for cobalt complexes in the presence of yellow arsenic. Beyond these compounds, the history of reactivity of cobalt and yellow arsenic dates back to 1978, when Sacconi and coworkers reported the reaction of cobalt tetrafluoroborate and yellow arsenic in the presence of 1,1,1-tris(diphenylphosphinomethyl)ethane. The resulting complex features a cyclic As3 moiety bridging two cobalt centers, of which the former is assigned formally as a 3π-electron system.[8] The reaction of [Cp*Co(CO)]2 dimer with yellow arsenic was shown by Scherer et al. to produce a wide variety of isolable products, featuring a mixture of linking arsenic moieties including cyclobutane-like and butterfly type complexes.[9] Analogous reactions with rhodium complexes are also known.[10]
Group 10 and 11 metals
[editovat | editovat zdroj]Among the group 10 and 11 elements, nickel and copper feature most prominently in literature reactions with yellow arsenic. Nickel tetrafluoroborate salts react analogously to cobalt complexes in the presence of triphos to form a sandwich structure with a central cyclic As3 moiety. Much like iron, the reaction of nickel cyclopentadienyl carbonyl complexes with As4 yields a variety of bi- and multi-metallic products depending on the size of the attending ligands, though the nature and geometric structure of these compounds differ from those observed with iron.[8] These include trimers with bridging As4 and As5 moieties in cubane structural arrangements when smaller Cp ligands are employed, and distorted hexagonal prism complexes with two nickel fragments and four arsenic atoms when bulkier Cp groups are introduced.
The reaction of the copper complex [L2Cu(NCMe)] (L2 = [{N(C6H3iPr2-2,6)C(Me)}2CH]) with yellow arsenic yields the As4-bridged dimer [{L2Cu}2- (μ,η2:2-As4)].[11] The four-atom arsenic moiety in this complex was deemed to be "intact" yellow arsenic through the use of density functional theory calculations determining the change in bond critical points between the free and bound arsenic molecules. Specifically, only a small shift was observed in the bond critical points between arsenic atoms involved in binding to copper; the remaining bond critical points were very similar to free yellow arsenic.
See also
[editovat | editovat zdroj]- ↑ a b c d e f Michael Seidl; Gábor Balázs; Manfred Scheer. The Chemistry of Yellow Arsenic. Chemical Reviews. 2019-03-22, s. 8406–8434. Dostupné online. ISSN 0009-2665. doi:10.1021/acs.chemrev.8b00713. PMID 30900440.
- ↑ Allotrope : Arsenic [online]. [cit. 2020-11-01]. Dostupné online.
- ↑ a b M. L. Ziegler. Darstellung und Charakterisierung von Tetrahedranen des Typs Cp3M3As(CO)6 und Cp2M2As2(CO)4 (Cp = C5H5, M = Mo, W) sowie von Derivaten dieser Tetrahedrane. Chemische Berichte. 1988. ISSN 0009-2940. doi:10.1002/cber.v121:1.
- ↑ a b Lai Yoong Goh; Richard C. S. Wong; Wai Hing Yip; Thomas C. W. Mak. Synthesis and thermolysis of di- and triarsenic complexes of chromium. Crystal structure of [CpCr(CO)2]2As2. Organometallics. 1991, s. 875–879. ISSN 0276-7333. doi:10.1021/om00050a015.
- ↑ Nikolas Antonatos; Jan Luxa; Jiri Sturala; Zdenek Sofer. Black Arsenic: A New Synthetic Method by Catalytic Crystallization of Arsenic Glass. Nanoscale. 2020, s. 5397–5401. Dostupné online. ISSN 2040-3372. doi:10.1039/C9NR09627B. PMID 31894222.
- ↑ a b SCHWARZMAIER, Christoph; TIMOSHKIN, Alexey Y.; BALÁZS, Gábor; SCHEER, Manfred. Selective Formation and Unusual Reactivity of Tetraarsabicyclo[1.1.0]butane Complexes. Angewandte Chemie International Edition. 2014, s. 9077–9081. Dostupné online. ISSN 1521-3773. doi:10.1002/anie.201404653. PMID 25123699. (anglicky)
- ↑ SCHERER, O. J.; BLATH, Christof; WOLMERSHÄUSER, Gotthelf. Ferrocene mit einem Pentaarsacyclopentadienyl-Liganden. Journal of Organometallic Chemistry. 1990-05-01, s. C21–C24. Dostupné online. ISSN 0022-328X. doi:10.1016/0022-328X(90)80029-Y. (německy)
- ↑ a b DI VAIRA, Massimo; MIDOLLINI, Stefano; SACCONI, Luigi. cyclo-Triphosphorus and cyclo-triarsenic as ligands in "double sandwich" complexes of cobalt and nickel. Journal of the American Chemical Society. 1979, s. 1757–1763. Dostupné online. ISSN 0002-7863. doi:10.1021/ja00501a019.
- ↑ SCHERER, Otto J.; PFEIFFER, Karl; WOLMERSHÄUSER, Gotthelf. Cobaltkomplexe mit As4-Liganden. Chemische Berichte. 1992-11-01, s. 2367–2372. Dostupné online. ISSN 0009-2940. doi:10.1002/cber.19921251107.
- ↑ SCHERER, Otto J.; HÖBEL, Bernd; WOLMERSHÄUSER, Gotthelf. Zweifach kantengeöffnetes P10-Dihydrofulvalen als 16-Elektronendonorligand. Angewandte Chemie. 1992, s. 1042–1043. Dostupné online. ISSN 0044-8249. doi:10.1002/ange.19921040811.
- ↑ SPITZER, Fabian; SIERKA, Marek; LATRONICO, Mario; MASTRORILLI, Piero; VIROVETS, Alexander V.; SCHEER, Manfred. Fixation and Release of Intact E4 Tetrahedra (E=P, As). Angewandte Chemie International Edition. 2015, s. 4392–4396. Dostupné online. ISSN 1521-3773. doi:10.1002/anie.201411451. PMID 25677593.
