Absolutní konfigurace

Absolutní konfigurace je prostorové uspořádání atomů v chirální molekule nebo funkční skupině a stereochemický popis tohoto stavu.[1] Absolutní konfigurace se obvykle určuje u molekul organických sloučenin, které mají na atom uhlíku navázaný čtyři různé substituenty; taková struktura vytváří dva možné enantiomery. Nejčastěji se enantiomery oznaučují, na základě Cahnových–Ingoldových–Prelogových pravidel, R or S'.
Enantiomery se mohou lišit chemickými vlastmostmi, ale jejich fyzikální vlastnosti bývají totožné, což ztěžuje jejich odlišení. Určování absolutních konfigurací (čistých) chirálních látek se obvykle provádí rentgenovou krystalografií, tento postup má ale několik omezení: enantiomerně čisté chirální molekuly mohou krystalizovat v jedné ze 65 Sohnckeových grup (chirálních prostorových grup).
Jinými možnostmi jsou disperze optické otáčivosti, vibrační cirkulární dichroismus, ultrafialovo-viditelná spektroskopie stereoizomerů, a protonová NMR s chirálně derivatizačními činidly.[2]
Historie
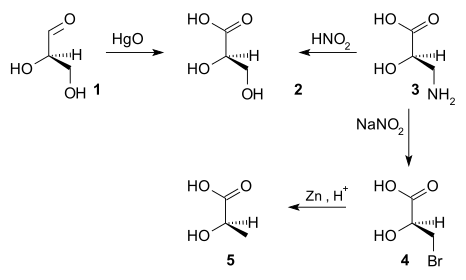
[editovat | editovat zdroj]Do poloviny 20. století nebylo určení absolutní konfigurace chirálních sloučenin možné; přibližně v této době bylo zvoleno, že se pravotočivý (+)-glyceraldehyd bude označovat jako D-enantiomer.[3][4] Konfigurace dalších chirálních sloučenin oproti (+)-glyceraldehydu byla poté určována posloupnostmi chemických reakcí; například oxidací (+)-glyceraldehydu (1) oxidem rtuťnatým vznikala (−)-kyselina glycerová (2), přičemž se neměnilo uspořádání stereocentra - absolutní konfigurace kyseliny (−)-glycerové tak musela být stejná jako u (+)-glyceraldehydu. Oxidací (+)-isoserinu (3) kyselinou dusitou se vytvářela kyselina (−)-glycerová, čímž bylo zjištěno, že také (+)-isoserin má tutéž konfiguraci.[5] (+)-isoserin lze přeměnit bromací na (−)-3-brom-2-hydroxypropanovou kyselinu (4), z níž redukcí zinkem kyselina (−)-mléčná (5), tím pádem se konfigurace kyseliny (−)-mléčné také shoduje.[6]
Pokud při reakci vznikal enantiomer sloučeniny o známé konfiguraci, což naznačoval opačný směr optické otáčivosti, tak to bylo známkou, že se absolutní konfigurace mění.
V roce 1951 Johannes Martin Bijvoet poprvé využil k určení absolutní konfigurace rentgenovou krystalografii;[7] zkoumanou sloučeninou byla (+)-sodno-rubidná sůl kyseliny vinné a zjištěna byla konfigurace (R,R).
Rentgenová krystalografie přinela pokrok ve zkoumání absolutních konfigurací molekul, vyznačuje se ale několika překážkami. Krystalizace molekul je náročná na čas a zdroje, a nelze ji použít u mnohých látek, jako jsou biomolekuly (výjimky tvoří některé bílkoviny) a in situ katalyzátory. Dalším omezením je nutná přítomnost „těžkých“ atomů, například bromu, která zvýrazňuje rozptyl rentgenových paprsků.[8] Navíc může být signál rušen vlivem sousedících atomů v krystalové mřížce a také roupouštědlem používaným při krystalizaci.
Později byly objeveny způsoby přímého určování absolutních konfigurací molekul v plynné fázi, často propojované s kvantově mechanickými teoretickými výpočty, které umožnily překonat některé nevýhody rentgenové krystalografie.[9]
Značení
[editovat | editovat zdroj]Podle absolutní konfigurace: R- a S-
[editovat | editovat zdroj]
Jedním ze způsobů označování enantiomerů jsou značky R/S. V tomto postupu se chirální centra označují R nebo S podle systému, kde má každý substituent přiřazenu prioritu podle Cahnových–Ingoldových–Prelogových pravidel, s přihlédnutím k atomovým číslům. Když se substituent s nejnižší prioritou umístí směrem od pozorovatele, nastávají dvě možnosti: pokud priority zzbývajících tří substituentů klesají ve směru hodinových ručiček, označí se izomer jako R, v opačném případě jako S).[10]
Označení (R) a (S) se zapisují kurzívou, v kulatých závorkách. Pokud molekula obsahuje více chirálních center, pak se jejich polohy upřesňují čísly, například (1R,4S).[11]
R/S systém nemá přímou souvislost s oznaačováním D/L; například vedlejšíé řetězec serinu obsahuje hydroxylovou skupinu −OH a pokud by tato byla nahrazena thiolovou skupinou −SH, tak by označení D/L, v souladu s definicí, nebxlo ovlivněno, ale tato substituce by obrátila značení R/S, protože CH2OH má menší prioritu než CO2H, ale CH2SH má Cahnovu–Ingoldovu–Prelogovu prioritu vyšší než CO2H. Z tohoto důvodu se v některých případech (zejména u sacharidů a aminokyselin) v biochemii používají označení D/L, jelikož je výhodné označovat chirální struktury podobného druhu u vyšších organismů stejně. V D/L systému mají téměř všechny přírodní aminokyseliny označení L, zatímco přírodní sacharidy jsou téměř všechny D. Všechny proteinogenní aminokyseliny jsou S, s výjimkou cysteinu, který je R.
Podle optické otáčivosti: (+)- a (−)- / d- a l-
[editovat | editovat zdroj]Enantiomery lze pojmenovat podle směru, kterým stáčejí rovinu polarizovaného světla. Otáčení světla, putujícího k pozorovateli, ve směru hodinových ručiček se označuje (+) nebo d- a otáčení opačným směrem (−) nebo l-; označení d- a l- je ale zaměnitelné s D- a L-.[12]
Podle relativní konfigurace: D- a L-
[editovat | editovat zdroj]- ↑ Šablona:GoldBookRef
- ↑ Martin Pitzer, Maksim Kunitski, Allan S. Johnson, Till Jahnke, Hendrik Sann, Felix Sturm, Lothar Ph. H. Schmidt, Horst Schmidt-Böcking, Reinhard Dörner, Jürgen Stohne, Julia Kiedrowski, Michael Reggelin, Sebastian Marquardt, Alexander Schießer, Robert Berger, Markus S. Schöffler. Direct Determination of Absolute Molecular Stereochemistry in Gas Phase by Coulomb Explosion Imaging. Science. 2013-07-06, s. 1096–1100. ISSN 0036-8075. doi:10.1126/science.1240362. PMID 24009390. Bibcode 2013Sci...341.1096.
- ↑ John D. Roberts; Marjorie C. Caserio. Basic Principles of Organic Chemistry. [s.l.]: W. A. Benjamin, 1977. Dostupné online. ISBN 9780805383294. S. 874–876.
- ↑ Paula Yurkanis Bruice. Organic Chemistry. [s.l.]: Pearson Education, 2014. Dostupné online. ISBN 9780321803221. S. 1020.
- ↑ T. W. Graham Solomons; Graig B. Fryhle. Organic Chemistry. [s.l.]: John Wiley & Sons, 2008. Dostupné online. ISBN 9780471684961. S. 212.
- ↑ Paula Yurkanis Bruice. Organic Chemistry. [s.l.]: [s.n.], 2004. Dostupné online. ISBN 9780131407480. S. 210.
- ↑ J. M. Bijvoet; A. F. Peerdeman; A. J. van Bommel. Determination of the Absolute Configuration of Optically Active Compounds by Means of X-Rays. Nature. 1951, s. 271–272. ISSN 0028-0836. doi:10.1038/168271a0. Bibcode 1951Natur.168..271B.
- ↑ J. Haesler; I. Schindelholz; E. Riguet; C. G. Bochet; W. Hug. Absolute configuration of chirally deuterated neopentane. Nature. 2007, s. 526–529. Dostupné online. ISSN 0028-0836. doi:10.1038/nature05653. PMID 17392783. Bibcode 2007Natur.446..526H.
- ↑ K. Fehre, G. Nalin, N. M. Novikovskiy, S. Grundmann, G. Kastirke, S. Eckart, F. Trinter, J. Rist, A. Hartung, D. Trabert, Ch. Janke, M. Pitzer, S. Zeller, F. Wiegandt, M. Weller, M. Kircher, M. Hofmann, L. Ph H. Schmidt, A. Knie, A. Hans, L. Ben Ltaief, A. Ehresmann, R. Berger, H. Fukuzawa, K. Ueda, H. Schmidt-Böckin, J. B. Williams, T. Jahnke, R. Dörner, Ph. V. Demekhin, M. S. Schöffler. A new route for enantio-sensitive structure determination by photoelectron scattering on molecules in the gas phase. Physical Chemistry Chemical Physics. 2022, s. 26458–26465. doi:10.1039/D2CP03090J. PMID 36305893. Bibcode 2022PCCP...2426458F.
- ↑ Andrew Streitwieser; Clayton H. Heathcock. Introduction to Organic Chemistry. [s.l.]: Macmillan Publishing Company, 1985.
- ↑ David R. Klein. Organic Chemistry. [s.l.]: [s.n.], 2013. ISBN 978-1118454312. S. 208.
- ↑ G. P. Moss. Basic terminology of stereochemistry (IUPAC Recommendations 1996). Pure and Applied Chemistry. 1996, s. 2193–2222. Dostupné online. ISSN 1365-3075. doi:10.1351/pac199668122193.