Oxid rutheničitý
| Oxid rutheničitý | |
|---|---|
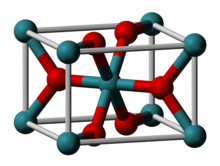 3D model krystalové struktury | |
| Obecné | |
| Systematický název | Oxid rutheničitý |
| Anglický název | Ruthenium dioxide |
| Německý název | Rutheniumdioxid |
| Sumární vzorec | RuO2 |
| Vzhled | modročerná práškovitá látka |
| Identifikace | |
| Registrační číslo CAS | 12036-10-1 32740-79-7 (hydrát) |
| Vlastnosti | |
| Molární hmotnost | 133,07 g/mol |
| Teplota rozkladu | 1 100 °C |
| Hustota | 6,97 g/cm3 |
| Rozpustnost ve vodě | nerozpustný |
| Měrná magnetická susceptibilita | 15,7×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | čtverečná |
| Hrana krystalové mřížky | a= 449,1 pm c= 310,7 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −305 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R36 |
| S-věty | S26, S39 |
Některá data mohou pocházet z datové položky. | |
Oxid rutheničitý (RuO2) je sloučeninou kyslíku s rutheniem, které v něm má oxidační číslo IV. Je amfoterní. Je to nejběžnější oxid ruthenia, jde o černomodrou pevnou látku, která krystaluje ve struktuře rutilu.[2] Využívá se jako katalyzátor při elektrolytické výrobě chloru, oxidů chloru a kyslíku.
Příprava
[editovat | editovat zdroj]Běžně se připravuje oxidací chloridu ruthenitého. Téměř stechiometrické monokrystaly RuO2 lze připravit chemickým transportem v plynné fázi s kyslíkem jako transportním plynem:
RuO2 + O2 ⇌ RuO4
Tenké filmy oxidu rutheničitého je možno připravit pomocí CVD z těkavých prekurzorů.[3]
Lze jej připravit i přímou oxidací kovového ruthenia kyslíkem za teploty 1000 °C.[2]
Využití
[editovat | editovat zdroj]Oxid rutheničitý se využívá jako katalyzátor, např. při výrobě chloru z chlorovodíku[4][5], při Fischerově-Tropschově syntéze[6] nebo v Haberově-Boschově procesu.
RuO2 se využívá jako povrchová úprava titanových anod pro elektrolytickou výrobu chlóru a pro výrobu rezistorů nebo integrovaných obvodů.[7][8] Tyto rezistory lze také využít jako citlivé senzory pro teploty v rozsahu 0.02 - 4 K.[8] Díky velké schopnosti přenosu náboje se využívají v superkondenzátorech. Ve vodném roztoku vykazuje vysokou kapacitu pro ukládání elektrického náboje.[9]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ a b Ruthenium(IV) oxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b GREENWOOD, NORMAN NEILL. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 8085427389, ISBN 9788085427387. OCLC 320245801 S. 1334.
- ↑ PIZZINI, S.; BUZZANCAE, G. Mat. Res. Bull. 1972, roč. 7, s. 449–462.
- ↑ VOGT, Helmut; BALEJ, Jan; BENNETT, John E. Chlorine Oxides and Chlorine Oxygen Acids. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 9783527306732. DOI 10.1002/14356007.a06_483. S. a06_483. (anglicky) DOI: 10.1002/14356007.a06_483.
- ↑ SEKI, Kohei. Development of RuO2/Rutile-TiO2 Catalyst for Industrial HCl Oxidation Process. Catalysis Surveys from Asia. 2010-9, roč. 14, čís. 3–4, s. 168–175. Dostupné online [cit. 2019-10-30]. ISSN 1571-1013. DOI 10.1007/s10563-010-9091-7. (anglicky)
- ↑ SCHULZ, Hans. Short history and present trends of Fischer–Tropsch synthesis. Applied Catalysis A: General. 1999-10, roč. 186, čís. 1–2, s. 3–12. Dostupné online [cit. 2019-10-30]. DOI 10.1016/S0926-860X(99)00160-X. (anglicky)
- ↑ BIANCHI, G. Fundamental and applied aspects of the electrochemistry of chlorine. Journal of Applied Electrochemistry. 1971-11, roč. 1, čís. 4, s. 231–243. Dostupné online [cit. 2019-10-31]. ISSN 0021-891X. DOI 10.1007/BF00688644. (anglicky)
- ↑ a b SIROUX, Monica; TANG-KWOR, Eric; MATTEÏ, Simone. Measurement Science and Technology. 1998-12, roč. 9, čís. 12, s. 1956–1962. Dostupné online [cit. 2019-10-31]. ISSN 0957-0233. DOI 10.1088/0957-0233/9/12/005.
- ↑ MATTHEY, Johnson. Nanocrystalline Ruthenium Supercapacitor Material. Johnson Matthey Technology Review [online]. [cit. 2019-10-31]. Dostupné online. (anglicky)
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Oxid rutheničitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxid rutheničitý na Wikimedia Commons



