Oxid fosforečný
| Oxid fosforečný | |
|---|---|
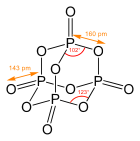 Strukturní vzorec oxidu fosforečného | |
 3D model oxidu fosforečného | |
| Obecné | |
| Systematický název | Oxid fosforečný |
| Anglický název | Phosphorus pentoxide |
| Německý název | Phosphorpentoxid |
| Sumární vzorec | P2O5 (monomer) P4O10 (dimer) |
| Vzhled | Bezbarvá hygroskopická pevná látka |
| Identifikace | |
| Registrační číslo CAS | 1314-56-3 16752-60-6 (dimer P4O10) |
| PubChem | 14812 |
| SMILES | O=P13OP2(=O)OP(=O)(O1)OP(=O)(O2)O3 |
| InChI | InChI=1S/O10P4/c1-11-5-12(2)8-13 (3,6-11)10-14(4,7-11)9-12 |
| Číslo RTECS | TH3945000 |
| Vlastnosti | |
| Molární hmotnost | 283,889 g/mol |
| Teplota tání | 422 °C (mod. M, zvýšený tlak) 558 °C (mod. R) 583 °C (mod. S) |
| Teplota sublimace | 359 °C (mod. M) 300 °C (amorfní mod.) |
| Hustota | 2,28 g/cm3 (mod. M) 2,72 g/cm3 (mod. R) 2,89 g/cm3 (mod. S) 2,38–2,39 g/cm3 (amorfní mod.) |
| Index lomu | modifikace M nDř= 1,469 nDm= 1,471 modifikace R nDa= 1,545 nDb= 1,578 nDc= 1,589 modifikace S nDa= 1,589 nDb= 1,599 nDc= 1,624 |
| Rozpustnost ve vodě | Prudká hydrolýza (vznik kyseliny fosforečné, všechny mod.) |
| Rozpustnost v polárních rozpouštědlech | Rozpustné v kyselině sírové (všechny mod.) |
| Měrná magnetická susceptibilita | −2,26×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | klencová (mod. M) kosočtverečná plošně centrovaná (mod. R) Kosočtverečná (mod. S) |
| Hrana krystalové mřížky | modifikace M a= 744 pm α= 87° modifikace R a= 1 630 pm b= 814 pm c= 526 pm modifikace S a= 923 pm b= 718 pm c= 494 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −2 985 kJ/mol (mod. M) −2 978 kJ/mol (mod. S) −3 043 kJ/mol (amorfní mod.) |
| Entalpie tání ΔHt | 252 J/g (mod. R) 260 J/g (mod. S) |
| Entalpie sublimace ΔHsub | 130 J/g (mod. M) |
| Standardní molární entropie S° | 229 JK−1mol−1 (mod. M) |
| Standardní slučovací Gibbsova energie ΔGf° | −2 699 kJ/mol (mod. M) |
| Izobarické měrné teplo cp | 0,746 JK−1g−1 (mod. M) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R35 |
| S-věty | S1/2, S22, S26, S45 |
| NFPA 704 |  1
3
3
|
Některá data mohou pocházet z datové položky. | |
Oxid fosforečný (P4O10) je anorganický oxid. Je to nejběžnější a nejdůležitější oxid fosforu. Vzniká hořením fosforu na vzduchu a vzhledem připomíná bílý prášek. Je dobře rozpustný v mnoha organických rozpouštědlech a je silně hygroskopický.
Struktura
[editovat | editovat zdroj]Molekula má adamantanoidní tvar, je tvořena čtyřmi šestičlennými cykly P3O3 s židličkovou konformací. Symetrie molekuly je tetraedrická.
Oxid fosforečný tvoří nejméně čtyři polymorfní krystalové modifikace.
Příprava
[editovat | editovat zdroj]Oxid fosforečný se připravuje řízenou oxidací bílého fosforu na vzduchu, při tlaku 12 kPa. Vznikající produkt je kontinuálně oddestilováván z reakční směsi.
- P4 + 5 O2 → P4O10
Použití
[editovat | editovat zdroj]Někdy se používá jako dehydratační činidlo, ale jeho využitelnost je snížena tvorbou viskózního fosforečnanového gelu na povrchu oxidu, který brání další hydrolýze.
- P4O10 + 6 H2O → 4 H3PO4 (-177 kJ)
Při reakci s karboxylovou kyselinou vzniká odpovídající anhydrid:
- P4O10 + RCO2H → P4O9(OH)2 + [RC(O)]2O
Příbuzné oxidy fosforu
[editovat | editovat zdroj]Mezi P4O6 a P4O10 existují tři oxidy, které se liší počtem exocyklicky vázaných kyslíků.
Reference
[editovat | editovat zdroj]- ↑ a b Phosphorus pentoxide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Oxid fosforečný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxid fosforečný na Wikimedia Commons


