Zelený fluorescenční protein
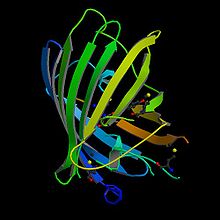
Zelený fluorescenční protein (správněji zelený fluorescentní protein) – zkratka GFP (z anglického Green fluorescent protein) je protein sestávající z 238 aminokyselin (26,9 kDa). Byl izolován z medúzy Aequorea victoria a jeho zvláštností je, že fluoreskuje zeleně, pokud je vystaven modrému světlu. V biochemii a molekulární biologii se často využívá jako reportérový gen pro vizualizaci exprese proteinů, on-line sledování in vivo traffickingu či testování lokalizace a kolokalizace různých proteinů.
Fluorescence a použití
[editovat | editovat zdroj]Přírodní gen GFP (wtGFP) z A. victoria má hlavní excitační maximum na vlnové délce 395 nm a vedlejší na 475 nm. Jeho emisní maximum je na 509 nm, což je linie v zelené části viditelného spektra. Jeho struktura je dosti jednoduchá – je tvořena 11 beta-vlákny, které se sbalují do velmi kompaktního beta-barelu. Uvnitř tohoto soudku se nachází vlastní chromofor, který je tak chráněn před vnějším prostředím. Chromofor vzniká cyklizací a následnou oxidací postranních zbytků aminokyselin Ser65, Tyr66 a Gly67.
V buněčné biologii se tento protein používá pro studium určitého genového produktu, ke kterému se naváže a později se snadno lokalizuje pomocí fluorescence. Po navázání proteinu k cílové struktuře je třeba ověřit, zda funkce struktury nebyla navázáním GFP změněna či zničena. Jde tak studovat např. dělení rakovinných buněk nebo vývoj neuronů.[1] Poněkud propracovanější metodou využívající GFP jsou např. FRAP nebo PA-GFP.[2]
Vedle zeleného fluorescentního proteinu jsou dnes k dispozici mj. také jeho žlutá (YFP) a modrozelená (CFP a BFP) varianta a nepříbuzný červený fluorescentní protein. Vyvinuta či objevena byla i celá řada dalších fluorescentních proteinů - v současnosti jich je již známo přes 1000. Významným souborným zdrojem informací o fluorescentních proteinech je tzv. FPbase, ve které je možné najít informace (původ, sekvence, optické a biofyzikální vlastnosti) o mnoha různých fluorescentních proteinech.[3]
Nobelova cena
[editovat | editovat zdroj]V roce 2008 obdrželi za objev a výzkum tohoto proteinu vědci Osamu Šimomura, Martin Chalfie, Roger Y. Tsien Nobelovu cenu za chemii.[4]
Osamu Šimomura izoloval látku z medúzy a objevil její fluorescenční schopnosti, Martin Chalfie zjistil, že GFP lze produkovat v jiných organismech a využít jej k pozorování jiných bílkovin a aktivity genů, a Roger Y. Tsien vysvětlil detaily fluorescenčního působení, vyvinul další barevné varianty tohoto proteinu a rozšířil rozsah jejich využití.[1]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ a b OTČENÁŠKOVÁ, Martina. Nobelova cena za chemii [online]. Český Rozhlas Leonardo, 2008-10-8 [cit. 2008-10-09]. Dostupné online.
- ↑ FRAP :: Mikroskopy [online]. Dostupné online.
- ↑ LAMBERT, Talley. FPbase: The Fluorescent Protein Database. FPbase [online]. [cit. 2024-11-18]. Dostupné online. (anglicky)
- ↑ The Nobel Prize in Chemistry 2008 [online]. Stockholm: Nobel Foundation, 2008-10-08 [cit. 2008-10-08]. Dostupné online. (anglicky)
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu zelený fluorescenční protein na Wikimedia Commons
Obrázky, zvuky či videa k tématu zelený fluorescenční protein na Wikimedia Commons
