Chemický vzorec

Chemický vzorec je grafické zobrazení složení, případně struktury a prostorového uspořádání molekul chemické sloučeniny nebo prvku za použití symbolů prvků, případně čísel a dalších znaků (např. závorek) a grafických prvků (čar a křivek).
Pod pojmem chemický vzorec se může skrývat řada různých reprezentací molekul. Česká terminologie označování jednotlivých kategorií chemických vzorců není zcela ustálená.
Stechiometrický vzorec
[editovat | editovat zdroj]Stechiometrický vzorec zaznamenává složení chemické sloučeniny bez ohledu na skutečný počet atomů v molekule. Zapisuje se jako řada symbolů prvků obsažených v dané sloučenině, případně doplněných číselnými indexy, umisťovanými vpravo dole za symbolem určitého prvku. Symbol každého z těchto prvků se vyskytne ve stechiometrickém vzorci právě jednou. Chceme-li zdůraznit, že se jedná o stechiometrický vzorec, uzavřeme jeho zápis do složených závorek { }.
Přitom pořadí zápisu symbolu prvků ve vzorci není podstatné, někdy se řadí abecedně, jindy podle vzrůstajícího protonového (atomového) čísla. Nejčastější praxe je u anorganických sloučenin taková, že se prvky ve vzorci řadí v pořadí kovy v pořadí vzrůstajících protonových čísel-vodík-významný (charakteristický) nekov-ostatní prvky v pořadí vzrůstajících protonových čísel. U organických sloučenin se obvykle řadí v pořadí uhlík-vodík-ostatní prvky v pořadí vzrůstajících protonových čísel. Číselné indexy u symbolů prvků vyjadřují relativní poměr jednotlivých atomů prvků v dané chemické sloučenině, nikoli nezbytně skutečný počet atomů v molekule. Tento způsob zápisu se nejčastěji používá u iontových sloučenin, u kterých vlastně molekuly neexistují; v pevné krystalické fázi nelze rozlišit příslušnost jednotlivých iontů k hypotetické molekule a v roztocích existují samostatné (případně solvatované) ionty.
Příkladem stechiometrického vzorce u iontových sloučenin může být:
| chlorid sodný | NaCl resp. {NaCl} |
| síran amonný | H8N2O4S resp. {H8N2O4S} |
| dusičnan draselný | KNO3 resp. {KNO3} |
| dusičnan amonný | H4N2O3 resp. {H4N2O3} |
U neiontových sloučenin se stechiometrické vzorce používají výjimečně, prakticky jen v případech, kdy u sloučeniny není známa její molekulová hmotnost. Pokud byl takový vzorec stanoven na základě chemické kvantitativní analýzy, pak se většinou hovoří o empirickém stechiometrickém vzorci nebo krátce o empirickém vzorci.
Příkladem stechiometrického vzorce u neiontových sloučenin může být:
| oxid dusičitý | {NO2} | počet atomů odpovídá jedné molekule monomerni formy, resp. polovině molekuly dimerní formy této sloučeniny |
| methan | {CH4} | počet atomů odpovídá jedné molekule |
| ethan | {CH3} | počet atomů odpovídá jedné polovině molekuly |
| benzen | {CH} | počet atomů odpovídá jedné šestině molekuly |
| glukosa | {CH2O} | počet atomů odpovídá jedné šestině molekuly |
Sumární vzorec
[editovat | editovat zdroj]Sumární neboli molekulový vzorec chemické látky udává prvky, z nichž se látka skládá, a počet jejich atomů v molekule. Na rozdíl od vzorce stechiometrického, s nímž může, ale nemusí být totožný, vyčteme ze sumárního vzorce skutečný počet atomů v molekule látky. Symbol každého z těchto prvků se vyskytne v molekulárním vzorci právě jednou. Je zřejmé, že jej lze striktně vzato použít pouze u sloučenin, které mají přesně definované molekuly, tedy nikoli u sloučenin iontových. Na rozdíl od vzorce strukturního nezjistíme ze sumárního vzorce nic o vzájemných vazbách a prostorovém uspořádání. Vzhledem k tomu se sumární vzorce běžně používají v anorganické chemii, jen velice zřídka v organické.
| Sloučenina | Stechiometrický vz. | Sumární vzorec |
|---|---|---|
| oxid dusičitý | NO2 | NO2 (monomer), N2O4 (dimer) |
| methan | CH4 | CH4 |
| ethan | CH3 | C2H6 |
| ethanol | C2H6O | C2H6O |
| dimethylether | ||
| kyselina octová | CH2O | C2H4O2 |
| methyl-formiát | ||
| glykolaldehyd | ||
| benzen | CH | C6H6 |
| glukóza (hexózy obecně) |
CH2O | C6H12O6 |
| inositol | ||
| peroxid vodíku | HO | H2O2 |
| uhličitan vápenatý | CaCO3 | CaCO3 |
| aceton | C3H6O | C3H6O |
| propanal | ||
| propylenoxid | ||
| oxetan | ||
| methyl(vinyl)ether |
Poslední tři uvedené sloučeniny mají stejný sumární vzorec, ale liší se svojí strukturou. Takové látky, složené ze stejných atomů a ve stejném počtu, ale různě uspořádaných, se nazývají izomery. Pokud mají různé funkční skupiny, nazývají se funkční izomery a jedná se o samostatné sloučeniny.
Funkční vzorec
[editovat | editovat zdroj]Funkční vzorec je speciální zápis vzorce molekulárního nebo stechiometrického, od nichž se liší tím, že pomocí symbolů prvků a číselných indexů jsou postupně zapisovány jednotlivé funkční skupiny (tj. skupiny atomů, které se v molekule projevují formou dolního indexu.
Příkladem funkčního vzorce může být:
- dusičnan amonný – NH4NO3
- síran amonný – (NH4)2SO4
- ethanol – C2H5OH
- kyselina octová – CH3COOH
U koordinačních sloučenin bývá zvykem komplexní část molekuly uzavírat do hranatých závorek, např.:
- tetrahydridohlinitan draselný – K[AlH4]
- hexakyanoželezitan draselný – K3[Fe(CN)6]
U nadmolekulových komplexů, zejména u hydrátů solí, se jednotlivé molekuly, tvořící tento komplex, zapisují samostatně a spojují se znakem „tečka“ bez mezer (odklepů). Pokud se na komplexu podílí více než jedna molekula určitého typu, jejich počet se zapíše číslem předcházejícím vzorec této molekuly (toto číslo se obvykle neodděluje od následujícího molekulárního vzorce). Tečka ve vzorci se čte „plus“.[zdroj?] Např.:
- heptahydrát síranu železnatého – FeSO4·7H2O
Strukturní vzorec
[editovat | editovat zdroj]Strukturní vzorec zobrazuje kromě počtu atomů v molekule i jejich vzájemné propojování, případně do menší či větší míry i geometrické uspořádání molekuly. Existuje proto řada různých druhů strukturních vzorců.
Konstituční vzorec
[editovat | editovat zdroj]V konstitučním vzorci se v rovině papíru zobrazují propojení jednotlivých atomů pomocí spojovacích čar (jednoduchých, zdvojených či ztrojených úseček, v případě potřeby i zakřivených čar), znázorňující vazby mezi atomy (jednoduché, dvojné nebo trojné vazby). Přitom délka spojovacích úseček a úhly mezi sousedními úsečkami nevyjadřují ani skutečnou délku vazeb v molekule, ani úhly mezi vazbami. Konstituční vzorce však umožňují rozlišit sloučeniny se stejným sumárním (molekulovým) vzorcem, například ethanol (CH3-CH2-OH) a dimethylether (CH3-O-CH3).
Konstituční vzorce existují ve čtyřech podobách.
Rozvinutý konstituční vzorec
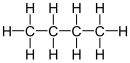
[editovat | editovat zdroj]V takovém vzorci jsou symboly prvků znázorněny všechny atomy, vyskytující se v molekule. Tento způsob lze z praktických důvodů použít pouze u velmi malých molekul, zejména anorganických látek, protože jinak zabírají velkou plochu a jsou značně nepřehledné.
Příklady:
Elektronový vzorec
[editovat | editovat zdroj]Elektronový vzorec se od prostého rozvinutého konstitučního vzorce liší tím, že kromě chemických vazeb mezi atomy (kdy jedna úsečka představuje dvojici elektronů sdílenou dvěma sousedními atomy) vyznačuje i další elektrony valenčních sfér atomů, které se však nepodílejí na chemických vazbách mezi těmito atomy. Jedná-li se o nepárový elektron, pak se označuje tečkou u symbolu příslušného atomu, volný elektronový pár pak krátkou úsečkou podél symbolu atomu.
Příklady:
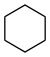
Racionální konstituční vzorec
[editovat | editovat zdroj]Racionální konstituční vzorce se používají zejména v organické chemii, jsou vyznačovány úsečkami (nebo křivkami) pouze vazby mezi uhlíkovými atomy, případně většími skupinami atomů, u nichž je jejich konstituční struktura běžně známa. Typickým příkladem je náhrada rozepsané struktury methylového radikálu, v němž jsou vázány jednoduchými vazbami tři atomy vodíku na jeden atom uhlíku zkráceným zápisem CH3, nebo methylenové skupiny, zápisem CH2. Jiným typickým případem je náhrada zápisu struktury radikálu fenylu (odvozeného od uhlovodíku benzenu) zápisem C6H5.
Podstatné je, že funkční skupiny, které dávají molekulám sloučeniny specifické chemické a fyzikální vlastnosti, jsou v racionálním konstitučním vzorci zřetelně vyznačeny a nezkracují se.
Příklady:
- butan – CH3–CH2–CH2–CH3
- kyselina octová – CH3–COOH
- kyselina γ-aminomáselná – H2N–CH2–CH2–CH2–COOH
- cyklohexan –
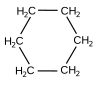
Zjednodušený racionální konstituční vzorec
[editovat | editovat zdroj]I u předchozího typu vzorců je grafický rozsah plochy potřebné pro jeho zápis u složitějších organických látek mnohdy značně velký. Další úspory místa se dosáhne tím, že ze zápisu konstitučního vzorce se zcela vyloučí zápis symbolů atomů uhlíku (obvykle s výjimkou koncových methylových skupin, které se ve vzorci explicitně uvádějí) a většiny atomů vodíku. V zápisu se předpokládá, že atomy uhlíku se vyskytují ve všech koncových bodech úseček (nebo zlomech křivek) a atomy vodíku se automaticky při „čtení“ vzorce doplňují k atomům uhlíku dle potřeby. Atomy vodíku se však zapisují vždy, jsou-li součástí funkčních skupin.
Příklady:
Geometrický vzorec
[editovat | editovat zdroj]U geometrického vzorce se jednoduchými grafickými prostředky (průmětem do roviny papíru) znázorní skutečná prostorová stavba molekuly. Obvykle se vazby směřující „před papír“ znázorňují zesilujícím úzkým klínem (viz příklad methanu), vazby ležící v rovině papíru normálními čarami a vazby směřující za papír se kreslí tečkovaně nebo čárovaně či šrafovaně.
Příklady:
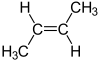
Konfigurační vzorec
[editovat | editovat zdroj]Konfigurační vzorec je speciální případ konstitučního vzorce, ve kterém je znázorněno specifické prostorové uspořádání molekul, které se neliší sledem propojení jednotlivých atomů, ale jejich prostorovým uspořádáním, přičemž jednu formu molekuly nelze převést ve druhou bez přerušení některé (některých) vazeb. Typickým příkladem je cis/trans isomerie na dvojné vazbě v organických sloučeninách, nebo stereoizomerie látek s centrem asymetrie (například u opticky aktivních látek).
Příklady:
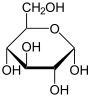
Zvláštním druhem konfiguračních vzorců používaných u sacharidů a jejich derivátů jsou vzorce ve Fischerově nebo Nattově projekci (obojí pro izomery s otevřeným řetězcem), případně Tollensově nebo Haworthově projekci (pro cyklické izomery).
Příklady:
- Konfigurační vzorce D-glukózy ve Fisherově a Nattově projekci:
- Konfigurační vzorce α-D-glukopyranosy v Tollensově a Haworthově projekci:
- Standardní strukturní vzorec β-D-glukopyranosy:
Konformační vzorec
[editovat | editovat zdroj]Zvláštním případem geometrického vzorce zobrazujícího geometrii molekuly je konformační vzorec, který zachycuje jednotlivé možnosti prostorového uspořádání molekuly, mezi nimiž může molekula přecházet v důsledku možného otáčení jejích částí kolem jednoduchých vazeb mezi vzájemně vázanými atomy.
Příklady:
- ethanol –
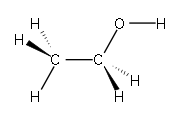
- cyklohexan (židlička) –
- cyklohexan (vanička) –
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu chemický vzorec na Wikimedia Commons
Obrázky, zvuky či videa k tématu chemický vzorec na Wikimedia Commons