Kyselina dusičná
| Kyselina dusičná | |
|---|---|
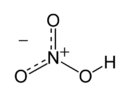 Strukturní vzorec | |
 Model molekuly kyseliny dusičné | |
 | |
| Obecné | |
| Systematický název | Kyselina dusičná |
| Triviální název | lučavka |
| Ostatní názvy | aqua fortis (silná voda) šalvostr |
| Latinský název | Acidum nitricum |
| Anglický název | Nitric acid |
| Německý název | Salpetersäure |
| Sumární vzorec | HNO3 |
| Vzhled | bezbarvá kapalina (čistá zbarvena do žluta) |
| Identifikace | |
| Registrační číslo CAS | 7697-37-2 |
| EC-no (EINECS/ELINCS/NLP) | 231-714-2 |
| Indexové číslo | 007-004-00-1 |
| PubChem | 944 |
| ChEBI | 48107 |
| UN kód | 2031 |
| Číslo RTECS | QU5775000 |
| Vlastnosti | |
| Molární hmotnost | 63,013 g/mol |
| Molární koncentrace cM | 7,913 mol/dm3 (20 °C, 40% roztok) |
| Teplota tání | −41,59 °C |
| Teplota varu | 84,1 °C 120,7 °C (vodný azeotrop) |
| Hustota | 1,521 5 g/cm3 (15 °C) 1,512 7 g/cm3 (20 °C) 1,504 9 g/cm3 (25 °C) 1,246 6 g/cm3 (20 °C, 40% roztok) |
| Dynamický viskozitní koeficient | 1,561 cP (20 °C, 40% roztok) |
| Kinematický viskozitní koeficient | 1,252 cS (20 °C, 40%roztok) |
| Index lomu | nD= 1,397 (16 °C) nD= 1,386 7 (20 °C, 40% roztok) |
| Disociační konstanta pKa | −1,4 |
| Rozpustnost ve vodě | neomezeně mísitelná |
| Relativní permitivita εr | 22 (−34 °C) |
| Měrná magnetická susceptibilita | −3,93×10−6 cm3g−1 |
| Struktura | |
| Dipólový moment | 7,205×10−30 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −173,22 kJ/mol |
| Entalpie tání ΔHt | 166,2 J/g |
| Entalpie varu ΔHv | 620 J/g |
| Entalpie rozpouštění ΔHrozp | −528,3 J/g |
| Standardní molární entropie S° | 156,6 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −80,8 kJ/mol |
| Izobarické měrné teplo cp | 1,744 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H272 H314 |
| R-věty | R8 R35 |
| S-věty | (S1/2) S23 S26 S36 S45 |
| NFPA 704 |  0
4
0
OX
|
Některá data mohou pocházet z datové položky. | |
Kyselina dusičná je významná silná minerální kyselina. Její vzorec je HNO3. K první přípravě kyseliny došlo ve 14. století někde v Evropě, ovšem je možné, že se ji podařilo připravit již ve 12. století v Indii (kvůli problémům s datací děl oné doby a nejednoznačnosti návodů v nich to ovšem zatím nelze potvrdit).[2]
Fyzikální vlastnosti
[editovat | editovat zdroj]Čistá bezvodá kyselina dusičná (100%) je bezbarvá kapalina s hustotou 1,513 g/cm3, která při teplotě −42 °C tuhne a vytváří bílé krystaly a vře při 83 °C. Na světle a vzduchu se již za pokojové teploty rozkládá na kyslík, oxid dusičitý a vodu.
4 HNO3 → 4 NO2 + O2 + 2 H2O
Oxid dusičitý se následně rozpustí ve zbývající kyselině dusičné a začne ji zbarvovat do žluta, za vyšších teplot do červena. Čistá kyselina má tendenci vypouštět do vzduchu bezbarvý dým, u již znečištěné kyseliny se její znečištění projevuje zbarvením tohoto dýmu do červenohněda, uvolňuje se totiž oxid dusičitý. Takováto kyselina se označuje jako dýmavá kyselina dusičná, koncentrace jejího roztoku pak přesahuje 86 %.
Koncentrovaná kyselina dusičná je 68,4%, s vodou vytváří azeotropickou směs. 1 l váží přibližně 1 400 g. Je nestálá, na vzduchu a světle se rozkládá na žlutohnědý jedovatý plyn, který obsahuje směs oxidů dusíku (souhrnné označení NOx), někdy nazývaných nitrózní plyny, proto se uchovává v lahvích s tmavým sklem a dvojitým uzávěrem.
Chemické vlastnosti
[editovat | editovat zdroj]
Kyselina dusičná je silná jednosytná kyselina a velmi silné oxidační činidlo schopné nitrovat velké množství organických sloučenin a látek.
Acidobazické vlastnosti
[editovat | editovat zdroj]Kyselina dusičná jako typická kyselina reaguje s hydroxidy, zásadotvornými oxidy a solemi slabších kyselin za vzniku vlastních solí, dusičnanů. Až na několik výjimek neodštěpuje při reakcích s kovy vodík jako většina ostatních kyselin, namísto toho se uvolňuje jeden z oxidů dusíku. Tento jev způsobují její silné oxidační vlastnosti. Ve vodném prostředí se úplně disociuje, dochází k uvolnění aniontu NO -
3 a vodíkového kationtu, který však následně vytvoří oxonium:
HNO3 + H2O → NO -
3 + H3O+
Oxidační vlastnosti
[editovat | editovat zdroj]Reakce s kovy
[editovat | editovat zdroj]Kyselina dusičná, jak již bylo uvedeno, se řadí mezi velmi silná oxidační činidla, proto většinou při reakcích s kovy neodštěpuje vodík. Kyselina dusičná reaguje s kovy, výjimku představují například zlato či platina, se kterými nereaguje. Zlato a platina se však rozpouští v lučavce královské. Při reakci koncentrované kyseliny se uvolňuje oxid dusičitý:
Při reakci zředěné kyseliny se uvolňuje oxid dusnatý:
- 3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO + 4 H2O
Existují však i výjimky, například dochází k uvolnění vodíku či oxidu dusného.
Pasivace kovu
[editovat | editovat zdroj]Některé kovy, například chrom, hliník, železo apod. se rozpouštějí ve zředěné kyselině dusičné, zatímco koncentrovaná kyselina při reakci s takovýmto kovem vytvoří na povrchu kovu ochranou vrstvu oxidu, tj. ochranné vrstvy, která zabraňuje dalšímu průběhu reakce. Tento jev se označuje jako pasivace kovu.
Reakce s nekovy
[editovat | editovat zdroj]Reakce kyseliny dusičné s nekovy s výjimkou křemíku a halogenů probíhají za vzniku oxidu dusíku, vody, ale ne soli kyseliny, jako u kovů, ale za vzniku oxidu nekovu na nejvyšším oxidačním stupni tohoto prvku.
Například při reakci koncentrované kyseliny dusičné s uhlíkem se uvolňuje oxid dusičitý (viz reakce s kovy) a zároveň oxid uhličitý:
- C + 4 HNO3 → CO2 + 4 NO2 + 2 H2O
Při reakci zředěné kyseliny dusičné s uhlíkem dochází opět ke vzniku oxidu uhličitého, ale již nevzniká oxid dusičitý, ale oxid dusnatý:
- 3 C + 4 HNO3 → 3 CO2 + 4 NO + 2 H2O
Reakce s organickými látkami
[editovat | editovat zdroj]Organické látky se působením kyseliny dusičné oxidují nebo nitrují. Právě nitrace je příčinou žloutnutí kůže, ke kterému dochází při polití. Žluté zabarvení způsobené reakcí kyseliny dusičné s bílkovinami se nazývá xantoproteinová reakce a používá se k důkazu bílkovin.
Rizika
[editovat | editovat zdroj]Kyselina dusičná je nebezpečná oxidující žíravina, poškozuje pokožku a sliznice, nebezpečné jsou i její výpary. Poleptání se projevuje charakteristickým zežloutnutím zasažených míst, což je důsledek reakce s bílkovinami. Dýmavá kyselina dusičná může při styku s hořlavými materiály (látka, papír) způsobit požár.
Výroba
[editovat | editovat zdroj]Průmyslově se – od objevu tohoto postupu Wilhelmem Ostwaldem v roce 1908 – kyselina dusičná vyrábí oxidací amoniaku (čpavku, azanu) za zvýšené teploty a tlaku, reakce je katalyzována kovovou platinou:
- 4 NH3 + 5 O2 → 4 NO + 6 H2O
- 2 NO + O2 → 2 NO2
- 3 NO2 + H2O → 2 HNO3 + NO
Poslední reakce vyjadřuje sumárně mnohem složitější děj, ve skutečnosti totiž při reakci oxidu dusičitého s vodou vzniká kromě kyseliny dusičné ještě kyselina dusitá, neuvolňuje se však již oxid dusnatý, ten vzniká až za následného rozkladu nestálé kyseliny dusité. Vzniklý oxid se následně opět zoxiduje na vyšší stupeň a opět vbíhá do reakce, až do té doby, než se veškerý oxid dusičitý přemění na kyselinu dusičnou:
- 2 NO2 + H2O → HNO3 + HNO2
- 3 HNO2 → HNO3 + 2 NO + H2O
Výroba kyseliny dusičné s větší koncentrací však probíhá trochu jinak, takováto kyselina se připravuje za reakce oxidu dusičitého s vodou a kyslíkem pod tlakem 50 atm, v podstatě se jedná o reakci protichůdnou k rozkladu kyseliny na vzduchu a světle:
4 NO2 + 2 H2O + O2 → 4 HNO3
Laboratorní příprava se většinou provádí jako vytěsnění z dusičnanu draselného, případně dusičnanu sodného pomocí kyseliny sírové a následnou destilací. Při použití koncentrované kyseliny sírové (96%) lze následnou destilací získat dýmavou kyselinu dusičnou o koncentraci 93–98 %.
Využití
[editovat | editovat zdroj]Kyselina dusičná má velké upotřebení v průmyslu. Používá se například k výrobě výbušnin pomocí nitrace, dusíkatých hnojiv, barviv a laků, léků a různých organických sloučenin. V chemickém průmyslu, laboratořích a raketové technice se používá jako okysličovadlo.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ a b Nitric acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ KARPENKO, Vladimír. Alchymie, Nauka mezi snem a skutečností. 1. vyd. Praha: Academia, 2007. ISBN 978-80-200-1491-7.
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
- SÝKOROVÁ, Dagmar; MASTNÝ, Libor. Návody pro laboratoře z anorganické chemie. 2. vyd. Praha: Nakladatelství VŠCHT, 2001. ISBN 80-7080-452-1.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu kyselina dusičná na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina dusičná na Wikimedia Commons


