Dioxolan
| 1,3-dioxolan | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1,3-dioxolan |
| Sumární vzorec | C3H6O2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 646-06-0 |
| EC-no (EINECS/ELINCS/NLP) | 211-463-5 |
| PubChem | 12586 |
| ChEBI | 87597 |
| SMILES | O1CCOC1 |
| InChI | InChI=1S/C3H6O2/c1-2-4-5-3-1/h1-3H2 |
| Vlastnosti | |
| Molární hmotnost | 74,079 g/mol |
| Teplota tání | −95 °C (178 K)[1] |
| Teplota varu | 78 °C (351 K)[1] |
| Hustota | 1,06 g/cm3 (20 °C)[1] |
| Index lomu | 1,3974 (20 °C)[1] |
| Rozpustnost ve vodě | rozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru[1] |
| Tlak páry | 10,5 kPa (20 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225}[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P280 P303+361+353 P370+378 P403+235 P501[1] |
| Teplota vzplanutí | 2 °C (275 K)[1] |
Některá data mohou pocházet z datové položky. | |
1,3-dioxolan (často nazývaný pouze dioxolan) je heterocyklická sloučenina a cyklický acetal se vzorcem (CH2)2O2CH2; jeho izomer 1,2-dioxolan je cyklický organický peroxid. Podobá se tetrahydrofuranu, který má místo jednoho kyslíku methylenovou (CH2) skupinu. Obdobný šestičlenný heterocyklus se nazývá dioxan. 1,3-dioxolan se používá jako rozpouštědlo a jako komonomer při přípravě polyacetalů.
Skupina sloučenin
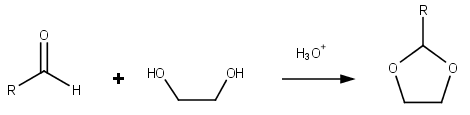
[editovat | editovat zdroj]Jako dioxolany se nazývají i další sloučeniny obsahující dioxolanové kruhy. Dioxolany se dají připravit reakcemi aldehydů a ketonů s ethylenglykolem.[2]
L-(+)-cis-2-Methyl-4-trimethylamoniummethyl-1,3-dioxolanjodid, triviálně nazývaný (+)-cis-dioxolan, funguje jako agonista muskarinového acetylcholinového receptoru.
Dioxolanové chránicí skupiny
[editovat | editovat zdroj]Organické sloučeniny obsahující karbonylové skupiny musejí být někdy chráněny, aby nevstupovaly do nežádoucích reakcí, když mají být prováděny reakce na jiných skupinách. K navázání a odštěpení chránicích skupin na karbonylové sloučeniny existuje velké množství postupů,[3] k nímž patří i využití dioxolanů.[4] Jako příklad lze uvést sloučeninu methylcyklohexanon-4-karboxylát, u kterého redukcí hydridem lithno-hlinitým vzniká 4-hydroxymethylcyklohexanol. Esterovou funkční skupinu lze zredukovat bez ovlivnění ketonové tím, že se keton přemění na ketal kysele katalyzovanou reakcí s ethylenglykolem, čímž se zamezí redukční reakci, chránicí skupina se poté odstraní hydrolýzou za vzniku 4-hydroxymethylcyklohexanonu.

K odstranění acetalových a ketalových chránicích skupin z karbonylových sloučenin lze také použít NaBArF4.[3][4] U 2-fenyl-1,3-dioxolanu trvá přeměna na benzaldehyd ve vodném roztoku při 30 °C pět minut.[5]
- PhCH(OCH2)2 + H2O PhCHO + HOCH2CH2OH
Výskyt
[editovat | editovat zdroj]Jednou z přírodních látek obsahujících 1,3-dioxolanové skupiny je neosporol, což je izomer sporolu.[6]
Byla popsána totální syntéza obou sloučenin; v každém z těchto případů se tvoří dioxolanový kruh reakcí s kyselinou trifluoroctovou, připravené karbamidperoxidovou metodou.[7][8]
Při tomto postupu se nepoužívá voda,[9] protože by způsobovala nežádoucí vedlejší reakce.[7]
- CF3COOCOCF3 + H2O2•CO(NH2)2 → CF3COOOH + CF3COOH + CO(NH2)2
U neosporolu se používá Priležajevova reakce[10] s kyselinou trifluorperoctovou na přeměnu vhodného allylalkoholového prekurzoru na epoxid, který následně podstupuje rozšiřování kruhu přes bližší karbonylovou skupinu za vzniku dioxolanového kruhu.[7][8]

Podobný postup se využívá při totální syntéze sporolu, kdy se později dioxolanový kruh rozšiřuje na dioxanový.[6]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Dioxolane na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m https://pubchem.ncbi.nlm.nih.gov/compound/12586
- ↑ R. A. DAIGNAULT, E. L. ELIEL. 2-Cyclohexyloxyethanol (involves acetalisation of cyclohexanone). Org. Synth.. 1973. Dostupné online.; Coll. Vol.. S. 303.
- ↑ a b Theodora W. Greene; Peter G. M. Wuts. Greene's Protective Groups in Organic Synthesis [online]. Wiley-Interscience, 1999 [cit. 2017-06-20]. S. 297–304, 724–727. Dostupné v archivu pořízeném z originálu dne 2016-12-03. ISBN 9780471160199.
- ↑ a b Theodora W. Greene; Peter G. M. Wuts. Greene's Protective Groups in Organic Synthesis [online]. Wiley-Interscience, 1999 [cit. 2017-06-20]. S. 308–322, 724–727. Dostupné v archivu pořízeném z originálu dne 2016-12-07. ISBN 9780471160199.
- ↑ Chih-Ching Chang; Bei-Sih Liao; Shiuh-Tzung Liu. Deprotection of Acetals and Ketals in a Colloidal Suspension Generated by Sodium Tetrakis(3,5-trifluoromethylphenyl)borate in Water. Synlett. 2007, s. 283–287. DOI 10.1055/s-2007-968009.
- ↑ a b Part B: Bicyclic and Tricyclic Sesquiterpenes. [s.l.]: John Wiley & Sons, 2000. (The Total Synthesis of Natural Products; sv. 11). ISBN 9780470129630. Kapitola 10. Neosporol, Sporol, s. 222–224.
- ↑ a b c Fredrick E. Ziegler; Chester A. Metcalf; Ashwini Nangia; Gayle Schulte. Structure and total synthesis of sporol and neosporol. Journal of the American Chemical Society. 1993, s. 2581–2589. DOI 10.1021/ja00060a006.
- ↑ a b Kenneth C. Caster; A. Somasekar Rao; H. Rama Mohan; Nicholas A. McGrath; Matthew Brichacek. e-EROS Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2012. ISBN 978-0471936237. DOI 10.1002/047084289X.rt254.pub2. Kapitola Trifluoroperacetic Acid, s. 283–287.
- ↑ Mark S. Cooper; Harry Heaney; Amanda J. Newbold; William R. Sanderson. Oxidation Reactions Using Urea–Hydrogen Peroxide; A Safe Alternative to Anhydrous Hydrogen Peroxide. Synlett. 1990, s. 533–535. DOI 10.1055/s-1990-21156.
- ↑ Timothy J. Hagen. Name Reactions of Functional Group Transformations. [s.l.]: John Wiley & Sons, 2007. ISBN 9780470176504. Kapitola Prilezhaev reaction, s. 274–281.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Dioxolan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dioxolan na Wikimedia Commons


![{\displaystyle {\ce {->[{\ce {NaBAr4}}][{\text{30 °C / 5 min}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fb42849d6133fe653a7fe5dd019b12e0f6184b5)