Adiponitril
| Adiponitril | |
|---|---|
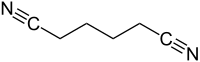 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | hexandinitril |
| Funkční vzorec | N≡C(CH2)4C≡N |
| Sumární vzorec | C6H8N2 |
| Vzhled | bezbarvá až nažloutlá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 111-69-3 |
| EC-no (EINECS/ELINCS/NLP) | 203-896-3 |
| PubChem | 8128 |
| SMILES | C(CCC#N)CC#N |
| InChI | InChI=1S/C6H8N2/c7-5-3-1-2-4-6-8/h1-4H2 |
| Číslo RTECS | AV2625000 |
| Vlastnosti | |
| Molární hmotnost | 108,14 g/mol |
| Teplota tání | 1 °C (274 K)[1] |
| Teplota varu | 295 °C (568 K)[1] |
| Hustota | 0,965 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | 8 g/100 ml (20 °C)[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v methanolu, ethanolu a chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v aromatických uhlovodících, omezeně rozpustný v diethyletheru, sirouhlíku a alifatických uhlovodících[1] |
| Tlak páry | 0,3 Pa (20 °C) 0,3 kPa (119 °C)[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H301 H315 H319 H332 H335[1] |
| P-věty | P260 P261 P264+265 P270 P271 P280 P284 P301+316 P302+352 P304+340 P305+351+338 P316 P317 P319 P320 P321 P330 P332+317 P337+317 P362+364 P403+233 P405 P501[1] |
| Teplota vzplanutí | 93 °C (366 K)[1] |
| Teplota vznícení | 550 °C (823 K)[1] |
Některá data mohou pocházet z datové položky. | |
Adiponitril je organická sloučenina se vzorcem (CH2)4(CN)2, používaná na výrobu nylonu 66.
Výroba
[editovat | editovat zdroj]První postupy
[editovat | editovat zdroj]Vzhledem k průmyslovému významu adiponitrilu bylo vyvinuto několik způsobů jeho výroby. První průmyslové postupy byly založeny na použití furfuralu a na chloraci buta-1,3-dienu na 1,4-dichlor-but-2-en, který se po reakci s kyanidem sodným měnil na hex-3-endinitril, posléze hydrogenovaný na adiponitril:[2]
- ClCH2CH=CHCH2Cl + 2 NaCN → NCCH2CH=CHCH2CN + 2 NaCl
- NCCH2CH=CHCH2CN + H2 → NC(CH2)4CN
Adiponitril se ojediněle také vyráběl z kyseliny adipové dehydratací jejího diamidu.
Moderní postupy
[editovat | editovat zdroj]Od roku 2004 se většina adiponitrilu vyrábí hydrokyanací butadienu katalyzovanou niklem. Celková rovnice vypadá takto:
- CH2=CHCH=CH2 + 2 HCN → NC(CH2)4CN
Proces se skládá z několika částí, první je monohydrokyanace (navázání jedné molekuly HCN), čímž vnikají (navzájem izomerní) pentennitrily a také 2- a 3-methylbutannitrily. Tyto sloučeniny se poté izomerizují na penten-3- a penten-4-nitrily. V posledním kroku se pentennitrily znovu, proti Markovnikovovu pravidlu, hydrokyanují a vzniká adiponitril.[2]
Penten-3-nitril, vzniklý při první hydrokyanaci, může projít metatezí alkenu za tvorby dikyanobutenů, které se snadno hydrogenují. Užitečným vedlejším produktem výroby adiponitrilu je 2-methylglutaronitril.
Dalšími významnými metodami jsou hydrodimerizace, která začíná u akrylonitrilu:[3]
- 2 CH2=CHCN + 2 e− + 2 H+ → NCCH2CH2CH2CH2CN
Použití
[editovat | editovat zdroj]Téměř všechen vyrobený adiponitril se hydrogenuje na hexan-1,6-diamin, sloužící na výrobu nylonu 66:[5]
- NC(CH2)4CN + 4 H2 → H2N(CH2)6NH2
Podobně jako další nitrily lze adiponitril hydrolyzovat; vzniklou kyselinu adipovou lze ale levněji vyrobit jinými postupy.
V roce 2018 se mohlo vyrobit až kolem 1,5 milionů tun adiponitrilu
Bezpečnost
[editovat | editovat zdroj]LD50 adiponitrilu u krys při ústním podání je 300 mg/kg.[2]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Adiponitrile na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m https://pubchem.ncbi.nlm.nih.gov/compound/8128
- ↑ a b c M. T. Musser, "Adipic Acid" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a01_269
- ↑ D. S. Cardoso; B. Šljukić; D. M. Santos; C. A. Sequeira. Organic Electrosynthesis: From Laboratorial Practice to Industrial Applications. Organic Process Research & Development. 2017-07-17, s. 1213–1226. DOI 10.1021/acs.oprd.7b00004.
- ↑ Manuel M. Baizer. Electrolytic Reductive Coupling. Journal of the Electrochemical Society. 1964, s. 215. DOI 10.1149/1.2426086.
- ↑ Robert A. Smiley Hexamethylenediamine, Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005 DOI:10.1002/14356007.a12_629
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Adiponitril na Wikimedia Commons
Obrázky, zvuky či videa k tématu Adiponitril na Wikimedia Commons - www.chemicalland.com
- www.nist.gov




