Osmotický tlak

Osmotický tlak je tlak, který způsobuje přirozený jev zvaný osmóza, pronikání rozpouštědla přes polopropustnou membránu do roztoku, ve kterém je vyšší koncentrace rozpuštěných molekul nebo iontů. Je závislý na teplotě a koncentraci roztoku. Vynucený opačný proces se nazývá reverzní osmóza.
Rozpouštědlo má snahu pronikat přes polopropustné membrány do míst, kde je koncentrace osmoticky aktivních látek vyšší a ředit je. Ve výsledku jsou tedy roztoky na obou stranách membrány stejně koncentrované. Osmotický tlak je jedna ze základních sil, které ovlivňují živé buňky, protože cytoplazmatická membrána je polopropustná.
Osmotický tlak zředěného roztoku se značí řeckým písmenem π a může být vypočítán za pomoci vzorce:
kde
- c je molární koncentrace
- R je molární plynová konstanta
- T je absolutní teplota
Jednobuněčné organismy
[editovat | editovat zdroj]Pro jednobuněčné organismy je životně důležité umět se vyrovnat s neustálým vstupem vody do buněk způsobeným osmotickým tlakem. Pulsující vakuoly některých prvoků fungují jako pumpy přečerpávající nadbytečnou vodu zpět do okolního prostředí.
Rostliny
[editovat | editovat zdroj]Osmotický potenciál buňky je tlak, pod nímž do cytoplazmy přes cytoplazmatickou membránu vniká čistá voda. Je tím vyšší, čím vyšší je koncentrace osmoticky aktivních látek v buňce.
Protože rostlinné buňky mají buněčnou stěnu, voda pronikající do buňky ji nemůže rozpínat. Toto napětí působící proti buněčné stěně se nazývá turgor. Turgor jednotlivých buněk tvoří oporu rostlinným tkáním. Při nedostatku vody se turgor snižuje a rostlina vadne.
Živočichové
[editovat | editovat zdroj]V těle živočichů, v jejich extracelulární tekutině, se udržuje přesně daná koncentrace iontů. Extracelulární prostředí je tak k prostředí uvnitř buňky isotonické a buňky tak nejsou poškozovány nadměrným přísunem vody nebo naopak jejím přílišným úbytkem. Kromě iontů solí se na celkové osmolalitě prostředí podílí anionty proteinů. Koloidně-osmotický tlak proteinů se nazývá tlakem onkotickým.
Význam onkotického tlaku proteinů krevní plazmy tkví v umožnění vzniku a následné resorbce tkáňového moku. Na začátku kapilár je hydrostatický tlak (generovaný srdcem) ve vlásečnici větší než onkotický tlak bílkovin krevní plazmy. Krevní plazma se tímto tlakem filtruje do tkání jako tkáňový mok nesoucí živiny. Na konci kapilár hydrostatický tlak poklesne, onkotický tlak je relativně vyšší a tkáňový mok (voda a metabolity buněk) je nasáván zpět do krevního oběhu. Při poklesu koncentrace bílkovin v krvi se objevují otoky, protože onkotický tlak už nestačí k vyčerpání nadbytečného moku.
Osmotické jevy
[editovat | editovat zdroj]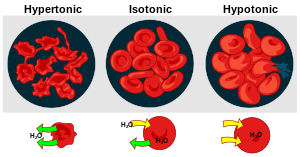
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu osmotický tlak na Wikimedia Commons
Obrázky, zvuky či videa k tématu osmotický tlak na Wikimedia Commons

